 Химия для фотографа Химия для фотографа
|
Профессиональному фотографу » Химия для фотографаПринципиальная схема получения цветного изображенияЭкспонированный фотоматериал проявляют в черно-белом проявляющем растворе, в результате чего получают цветоделенные черно-белые негативные изображения в трех слоях, состоящие из металлического серебра.
Затем следует интенсивная промывка, чтобы удалить остатки проявляющего раствора из слоев. На этой стадии заканчивают обработку фотоматериала в темноте. Все последующие операции можно производить на свету. Промежуточная засветка производится для экспонирования тех участков эмульсии, которые не были проявлены в черно-белом проявителе. Цветное проявление засвеченных участков. Поскольку слои уже имеют негативные изображения, то изображения, проявляемые цветным проявителем, в трех слоях соответствуют позитивному изображению. В результате цветного проявления в каждом слое получается два позитивных изображения, состоящих из металлического серебра и из красителя вокруг проявленного кристалла. Химия образования красителя при цветном проявлении может быть показан следующим суммарным уравнением: 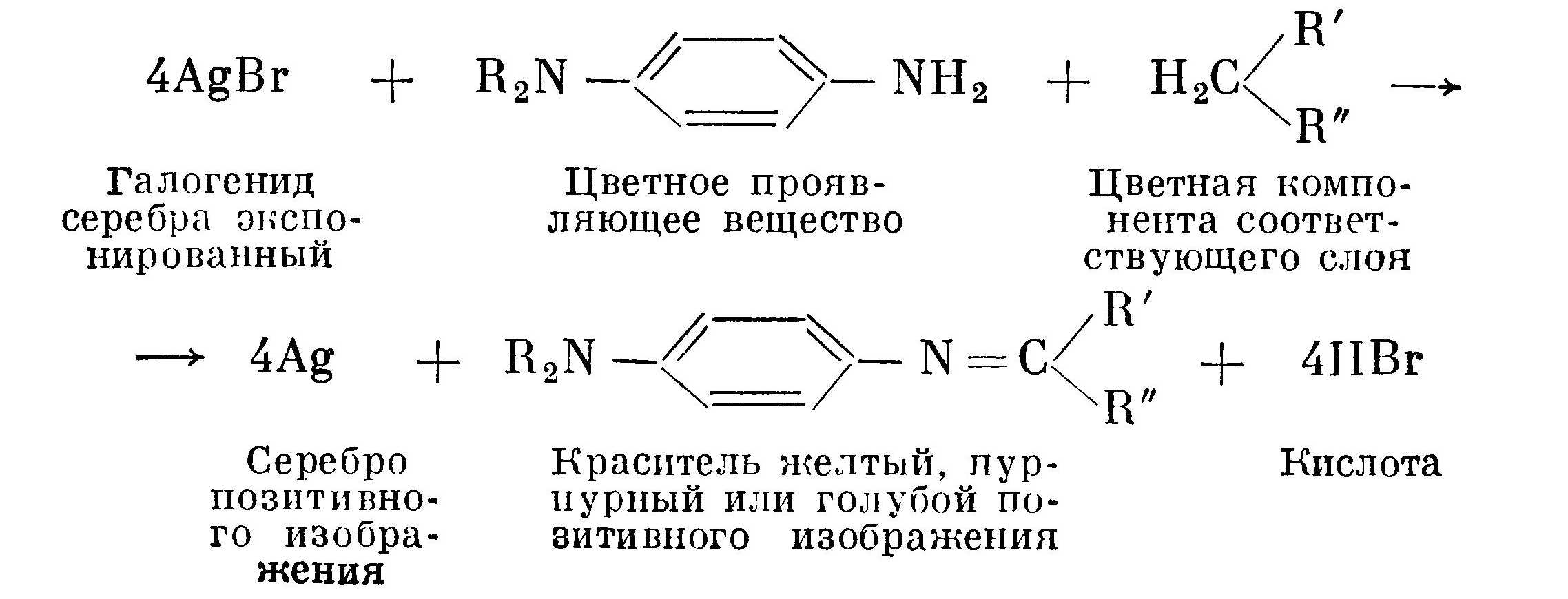
Технология обработки и методы управления балансом цветаСамый простой и быстрый путь получения цветных изображений — это съемка на цветные обращаемые фотоматериалы и самостоятельная обработка их. В продаже имеются цветные обращаемые фотоматериалы типа ЦО-22-Д, ЦО-32-Д, «Орвохром» (Символы расшифровываются следующим образом: ЦО — цветная обращаемая; 22 — светочувствительность в ед. ГОСТ; Д, Л — баланс фотоматериала для дневного света или света ламп накаливания. Для немецких фотоматериалов: U — обращаемая, Т — для дневного света, К — для ламп накаливания, 18 — светочувствительность в ед. DIN.). Фотоматериалы типа ЦО и «Орвохром» почти идентичные по процессам обработки. Успех обработки цветных обращаемых фотоматериалов зависит прежде всего от соблюдения температурного режима, продолжительности процесса, интенсивности перемешивания, тщательности приготовления растворов, точности поддержания их кислотности (рН), качества промывки (особенно после проявляющих растворов и после фиксирования). Поскольку окончательное цветное изображение синтезируется из трех цветоделенных изображений, очень важно поддерживать постоянными скорость диффузии реагирующих веществ и активность раствора. Диффузия зависит от температуры, интенсивности перемешивания и рН раствора. Совокупность этих факторов влияет на степень проявленности каждого из трех слоев. Это прежде всего относится к первому (черно-белому) проявлению.
Обработка цветных фотоматериаловРежимы обработки отечественных обращаемых фотоматериалов типа ЦО-22-Д, ЦО-32-Д, а также фотоматериалов типа «Орвохром» приведены в табл. 11.
Таблица 11
Стандартные режимы обработки цветных обращаемых фотоматериалов ЦО-22-Д, ЦО-32-Д, «Орвохром UT18», «Орвохром UК17»
 * Время первого проявления для отечественных фотоматериалов указывается на упаковке. Обычно оно составляет около 12 мин. Фотоматериалы «Орвохром» проявляют 10 мин, кроме «UK17», которую проявляют 6 — 7 мин ** После промывки фотопленку можно высушить. Дальнейшую обработку можно проводить в любое удобное время. Перед цветным проявлением фотопленку рекомендуется размочить в воде в течение 5 мин пои температуре не ниже 22 0С. *** В свежем растворе отбеливание протекает быстрее.
Обработка цветных фотоматериалы фирмы «Кодак»Цветные обращаемые фотоматериалы фирмы «Кодак» «Эктахром-Х», «Эктахром-HS» тип D и «Эктахром-HS» тип В обычно обрабатывают в фирменных наборах химикатов по процессам Е-3 или Е-4. Процесс Е-3 проводится при температуре растворов 24°С. Процесс Е-4 отличается от процесса Е-3 отсутствием промежуточной засветки, роль которой выполняют специальные вещества — активные неизбирательные восстановители, добавляемые в цветной проявитель. Кроме того, процесс форсирован по температурному режиму обработки. Нормальная температура основных рабочих растворов составляет 29,5°С с допуском +- 1/4 °C. Выполнение таких жестких условий обработки возможно лишь при наличии специального оборудования. Фирма-изготовитель не раскрывает рецептуру обрабатывающих растворов, и тем не менее в различное время
Можно ли цветной обращаемый фотоматериал обработать как цветной негативный?Доброкачественный цветной диапозитив окантовывают в соответствующую диапозитивную рамочку и проецируют диапроектором на экран или же рассматривают через специальные устройства, так называемые диаскопы.
Часто возникают вопросы, связанные с размножением диапозитивов, использованием недоброкачественных диапозитивов и т. д. Рассмотрим некоторые наиболее часто встречающиеся вопросы, встающие перед фотографом. Можно ли цветной обращаемый фотоматериал обработать как цветной негативный?
Принципиально это возможно, но негатив будет слишком контрастным и получить доброкачественный цветной фотоотпечаток с него практически невозможно, так как цветная фотобумага рассчитана для печатания с «мягкого» негатива. Однако таким способом обработки можно воспользоваться, если требуется сделать контрастнее объект съемки. Заметим только, что естественной цветопередачи не будет, так как красители, получаемые в негативных и обращаемых фотоматериалах, различны. Соответственно в окончательном цветном фотоотпечатке будет искаженная цветопередача.
Можно ли с цветного диапозитива получить копии цветных диапозитивов?Да, можно. Для этого следует переснять диапозитив в масштабе 1 : 1 на специальные цветные обращаемые фотопленки для печати, например «Орвоколор UD1». Эти низкочувствительные фотоматериалы специально предназначены для размножения диапозитивов. Они сбалансированы для печатания с лампами накаливания. Желаемый баланс цвета может быть откорректирован с помощью корректирующих светофильтров таким же способом, как это делается при печатании с цветного негатива на цветную фотобумагу.
Можно ли изготовить цветной фотоотпечаток непосредственно с цветного диапозитива?Да, можно. Для этого используют специальную цветную обращаемую фотобумагу. Способ печатания аналогичен печатанию с цветного негатива на цветную фотобумагу, с тем лишь различием, что процесс обработки идет с обращением.
Можно ли изготовить черно-белый фотоотпечаток с цветного диапозитива?Да, можно. Для этого сначала изготовляют промежуточный черно-белый негатив, с которого обычным способом печатают на черно-белую фотобумагу. Целесообразнее всего промежуточный негатив получить на ортохроматической стеклянной фотопластинке или листовой фотопленке форматом 9x12 или 13x18 см с помощью фотоувеличителя. Обработку ведут в медленноработающем негативном проявителе. Промежуточный негатив должен быть плотным, с тем чтобы изображение воспроизводилось прямолинейным участком характеристической кривой. Печатание на фотобумагу ведется контактным способом.
Можно ли изготовить черно-белый диапозитив непосредственно с цветного диапозитива?Да, можно. Для этого необходимо произвести контактную или оптическую печать на черно-белый обращаемый фотоматериал и обработать фотоматериал способом обращения либо изготовить черно-белый промежуточ ный негатив, а затем — позитив.
Оптическую печать выполнить легче, чем контактную, особенно если требуется изготовить малоформатный негатив. Кроме того, возможна выкопировка только требуемой части кадра. На рис 27 показана принципиальная схема установки оптической печати для изготовления диапозитива или промежуточного негатива в требуемом масштабе. Задача съемки сводится к определению расчетным путем только двух параметров: 1) величины выдвижения объектива, или толщины промежуточных колец, устанавливаемых между объективом и корпусом камеры,— х'; 2) места положения репродуцируемого оригинала (диапозитива или негатива) относительно фильмового канала камеры, т. е. расстояния между оригиналом и фильмовым каналом Р; у — линейный размер предмета (оригинала); у' — линейный размер изображения; f' — фокусное расстояние объектива; x = f' * y/y' — расстояние от предмета до переднего фокуса объектива; x'= f' * y'/y--расстояние от заднего фокуса объектива до изображения; P — расстояние от предмета до изображения Р = х + x' + 2f'. 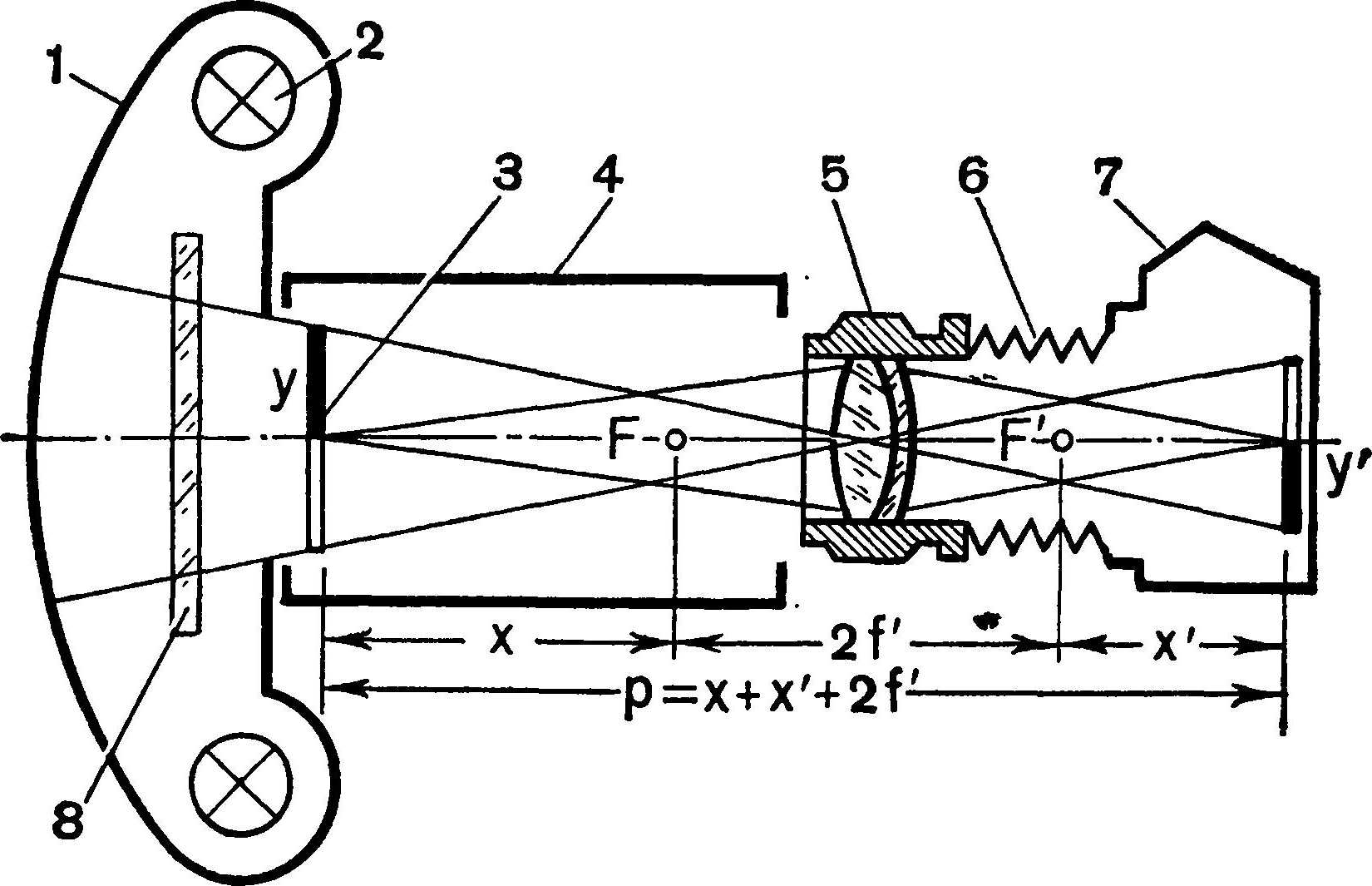 Рис. 27. Принципиальная схема установки оптической печати для изготовления диапозитива или промежуточного негатива: 1 — белый экран; 2 — источник света; 3 — оригинал (диапозитив или негатив); 4 — светозащитная бленда; 5 — объектив; 6 — мех или промежуточные кольца; 7 — фотокамера типа «Зенит»; 8 — корректирующий светофильтр для цветной печати
Иногда встречаются случаи, когда получается недоброкачественный цветной диапозитив, например сильно разбалансированный по цвету, очень плотный или же слишком светлый и т . п.В этих случаях также целесообразно изготовить черно-белый диапозитив. Для этого надо либо переснять диапозитив на черно-белый обращаемый фотоматериал, либо сделать промежуточный черно-белый негатив.
Что делать, если цветной обращаемый фотоматериал ошибочно обработан, как черно-белый негативный фотоматериал?Изображение в этом случае состоит из металлического серебра. Кроме того, имеются два равномерных слоя: желтый фильтровый и серо-коричневый противоореольный, также состоящие из металлического серебра. На просвет почти ничего не видно. Печатать с такого негатива бесполезно. Для того чтобы получить позитивные изображения, следует фотоматериал обработать в цветном проявителе и во всех других растворах и с полученного цветного негатива печатать черно-белые позитивы. Для печатания на цветную фотобумагу такой негатив малопригоден. Цветное негативное изображение образуется за счет оставшихся в слое цветных компонент, которые могут вступать в реакцию только с окисленной формой цветного проявляющего вещества. Обработку проводят следующим образом. Негатив тщательно промывают в проточной воде. После промывки негативное серебряное изображение, а вместе с ним противоореольный и фильтровый серебряные слои подвергаются отбеливанию, т. е. переводятся в галогенид серебра. Затем следует тщательная промывка и засветка фотопленки с двух сторон, как в процессе обращения. Теперь засвеченное изображение, состоящее из галогенида серебра, проявляют цветным проявителем. После промывки следует повторное отбеливание с целью перевода всего металлического серебра в галогенид серебра. Далее идет промывка, фиксирование и окончательная промывка. Продолжительность процесса в мин при температуре 20—25°С и последовательность операций следующие: Промывка............. 10 Отбеливание............ 5 Промывка............. 15 Засветка .............. 5 Цветное проявление........ 6—10 Промывка............. 15 Отбеливание............ 5 Промывка............. 5 Фиксирование........... 5 Промывка............. 15 Сушка..... — Во всех стадиях обработки спираль следует вращать. Промывку проводить в проточной воде.
Основные понятия атомно-молекулярной теорииХимия — наука о веществах, их свойствах, превращениях и способах управления этими превращениями. Теоретическую основу химии составляет атомно-моле-кулярное учение, основы которого были высказаны еще М. В. Ломоносовым и впоследствии развиты А. Лавуазье, Д. И. Менделеевым и другими учеными. Вещества состоят из молекул. Молекулами называют наименьшие частицы вещества, сохраняющие его химические свойства. Молекулу можно рассматривать как предел дробления вещества. При химических реакциях одни молекулы разрушаются, а вместо них образуются другие. Молекулы веществ состоят из еще более мелких, химически неделимых частиц — атомов. Каждый вид атома называется химическим элементом, которому присвоен свой символ (Символы, которыми сейчас пользуются, были введены шведским химиком Й. Берцелиусом в 1818 году.). Атомы разных элементов и веществ отличаются массой, размерами и другими свойствами. Масса атома, выраженная в условных единицах, называется атомным весом, а масса молекулы — молекулярным весом. Атомы и молекулы находятся в движении. Одна из форм движения атомов — химическая реакция. Химическая реакция — явление, в результате которого из атомов, составляющих молекулы исходных веществ, образуются молекулы новых веществ. Химические реакции сопровождаются различными физическими явлениями: изменением физического состояния веществ, излучением света, выделением или поглощением тепла. При помощи символов химических элементов составляются химические формулы. Химическая формула — изображение состава молекулы вещества посредством символов химических элементов, входящих в состав молекулы. Химическая формула вещества показывает, из каких элементов состоит вещество, сколько атомов каждого элемента содержится в молекуле, в каком весовом соотношении элементы входят в состав вещества, каков молекулярный вес вещества.
Диссоциация солей, кислот и оснований. Кислотность их растворовРазличные соли, кислоты и основания при растворении в воде диссоциируют (распадаются) на ионы. Ион — заряженная отрицательно или положительно составная часть вещества. Положительно заряженный ион называется катионом, так как при пропускании через раствор постоянного тока он движется к катоду (отрицательному электроду). Отрицательно заряженный ион называется анионом по той же аналогии.
Кислота диссоциирует на катион водорода Н' и кислотный остаток — анион: 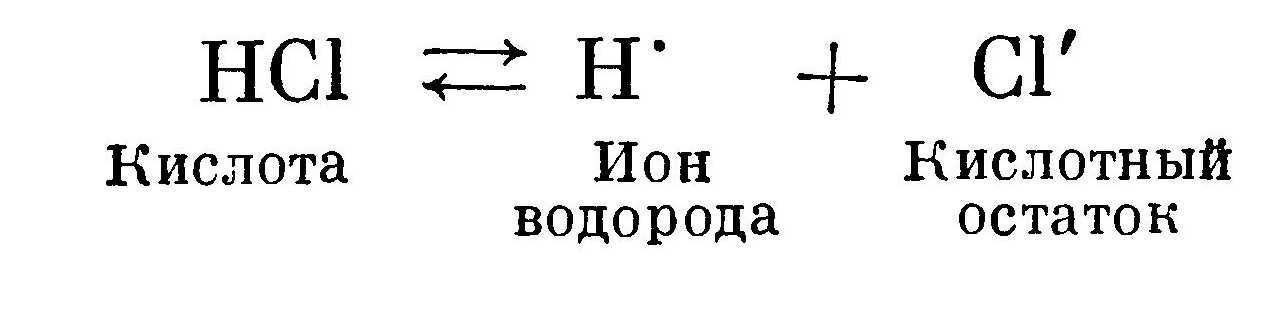 Стрелки указывают на то, что реакция идет в обоих направлениях.
Основание диссоциирует на катион и гидроксильную группу ОН': 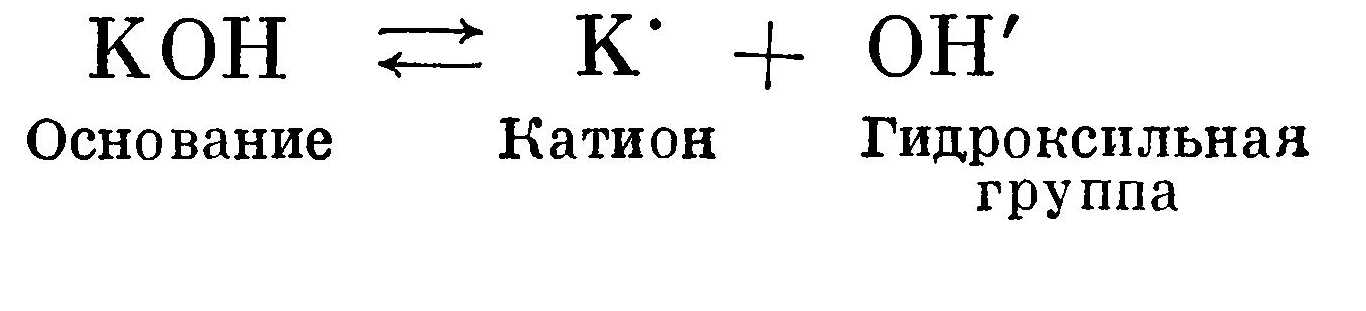 Соль диссоциирует на катион металла (или какой-либо положительный ион) и кислотный остаток:
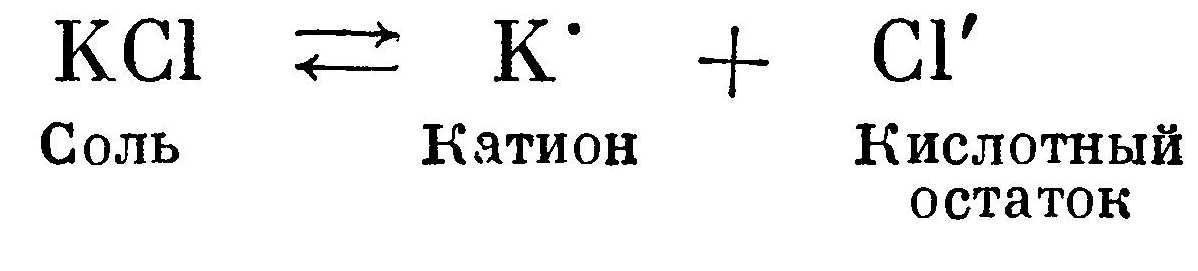
Кислоты, основания, соли и гидролиз солейКислотами называют соединения, которые в водных растворах дают в качестве катиона только положительно заряженный ион водорода. Кислотным остатком является анион — отрицательно заряженный ион. Кислотный остаток — соединение неметаллическое, в большинстве случаев в его состав входит кислород. Исключение составляют кислотные остатки галогенидных кислот (HCl, НВr и т. д.) и синильной кислоты HCN. Чем больше концентрация водородных ионов в растворе, тем сильнее кислота. Сильные кислоты в водных растворах диссоциируют практически полностью. Водные растворы слабых кислот, кроме того, имеют частично диссоциированные молекулы и совершенно недиссоцииро-ванные молекулы. Например, раствор борной кислоты Н3ВO3 содержит катионы водорода Н , кислотные остатки ВO'''3, НВO''3, Н2ВO'3 и недиссоциированные молекулы Н3В03. Причем полностью диссоциированных молекул очень мало. Следовательно, в растворе борной кислоты мала концентрация водородных ионов. Чем больше концентрация водородных ионов в растворе, тем сильнее кислота и соответственно меньше величина рН раствора. К сильным кислотам относятся соляная НСl, азотная HNO3, серная H2SO4; к слабым кислотам — сернистая H2SO3, угольная Н2СO3, ортофосфорная Н3РO4, борная Н3ВO3, а также большинство органических кислот.
Гидролиз карбоната натрия и Сульфит натрияГидролиз карбоната натрия Na2CO3.
Соль получена в результате реакции взаимодействия между сильным основанием NaOH и слабой кислотой Н2СO3. Сама по себе соль
нейтральна, так как она не содержит ни одного атома водорода или гидроксила. В растворе соль диссоциирует на ионы Na' и С03. Вода также диссоциирована на ионы Н' и ОН', но число их одинаково и реакция нейтральная: 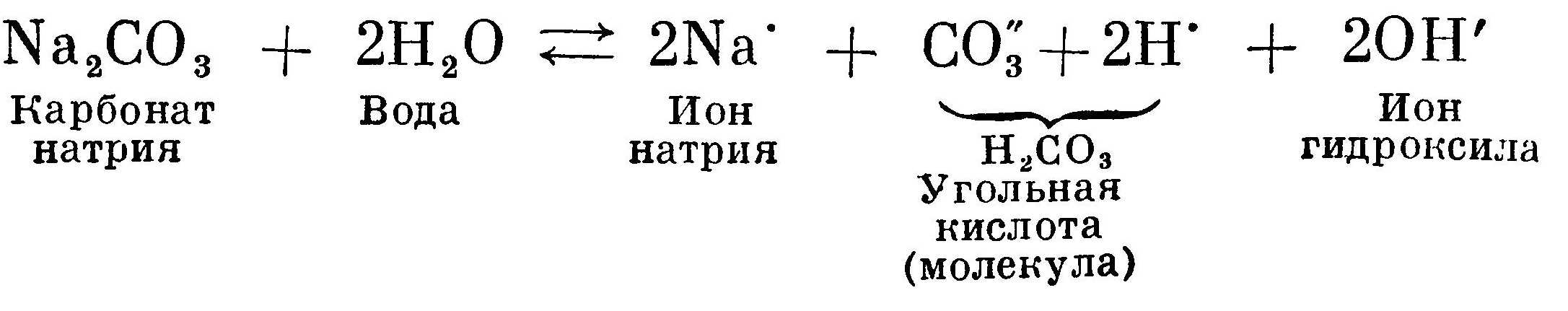
Определение величины рН раствораВеличина рН раствора может быть определена различными способами. Заметим, что определение величины рН, а также титрование раствора требуют соответствующих навыков в работе, аккуратности и точности со стороны исполнителя. Индикаторы — органические цветные вещества, которые меняют свой цвет с.изменением концентрации водородных ионов в том растворе, в который они добавлены. Поэтому можно рекомендовать только самые простые индикаторы: многоцветные индикаторные бумаги. Для определения рН раствора полоску цветной индикаторной бумаги смачивают раствором. После этого наблюдают окраску среднего широкого контрольного поля. Величина рН раствора определяется по соответствующему полю сравнительной шкалы. На рис 2 изображен образец многоцветной индикаторной бумаги, а в табл. 3 даны количественные характеристики индикаторной бумаги ФАН.
Химикаты для фотографических растворовКаждому веществу можно дать характеристику по его внешнему виду, растворимости в воде, основным химическим свойствам и области применения, а также степени чистоты. Химические вещества разделяются на четыре группы по чистоте: чистые — Ч, чистые для анализа — ЧДА, химически чистые — ХЧ и особой чистоты — ОСЧ. Для фотографических растворов вполне достаточен продукт марки Ч. Химикаты марки «Фото» специально предназначены для фотографических растворов. Они должны быть очищены от вредных примесей, влияющих на качество изображения. По форме химические вещества весьма разнообразны: кристаллические, гранулированные, порошкообразные. Некоторые вещества могут быть в двух состояниях! кристаллическом ибезводном. Например, сода кристаллическая и сода безводная. Поскольку кристаллизационная вода входит в состав молекулы вещества, то кристаллического вещества берется соответственно больше, чем безводного.
Алюминий сульфат, сернокислый алюминийАлюминий сульфат, сернокислый алюминий, Al2(S04)3·18Н20. Белые прозрачные кристаллы или порошок. Растворимость 32,2 г. Является активной составной частью стабилизирующих растворов. Снижает набухаемость желатинового эмульсионного слоя и тем самым противодействует гидролитическому распаду красителей в цветных изображениях. Может быть заменен эквивалентным количеством алюмокалиевых квасцов.
Амидол, 2,4-диамино-1-фенолхлоргидрат, амфолитАмидол, 2,4-диамино-1-фенолхлоргидрат, амфолит.
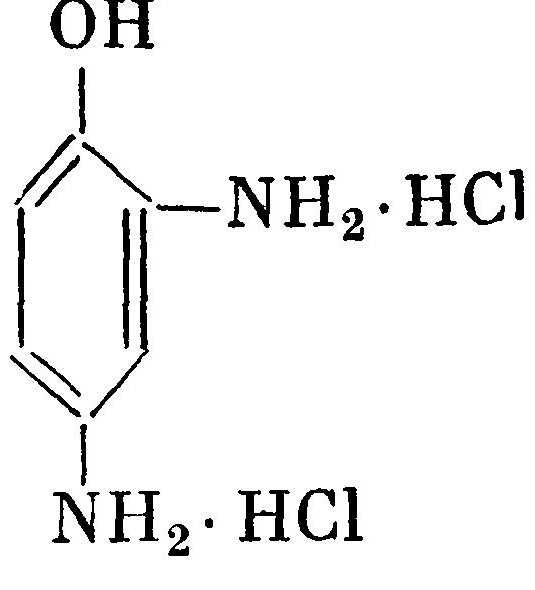 Бесцветные кристаллы игольчатого типа Легко растворим в воде. Водный раствор имеет кислую реакцию. Начинает проявлять при pH=4,0. Амидол дает проявители, энергично работающие без добавлении щелочи в раствор. Если добавить щелочи то она повышает активность проявителя до рН = 10, после чего- скорость проявления падает Щелочные растворы очень быстро окисляются. Сохраняемость проявляющих растворов с амидолом незначительна поэтому в них можно добавлять молочную кислоту или метабисульфит калия в концентрации до 5 г/л. Амидоловые проявители пригодны для обработки фотобумаг и диапозитивов, на которых они дают глубокие сине-черны тона.
АммиакАммиак, NH3. Газ с характерным резким запахов легко растворим в воде. Водный раствор бесцветен, имеет сильно щелочную реакцию и резкий запах. Водный раствор аммиака, или гидрат окиси аммония NH4OH, называется нашатырным спиртом. Содержании аммиака в воде определяется по удельному весу. 35%-ны раствор имеет удельный вес 0,88; 25%-ный раствор -0,91; 10%-ный раствор — 0,96. В фотографической практике обычно применяется 25%-ный раствор аммиака в качестве щелочи.
|
 Опрашиваем фотографов Опрашиваем фотографов
 Популярные материалы Популярные материалы
|
Загрузка. Пожалуйста, подождите...

