 Химия для фотографа Химия для фотографа
|
Профессиональному фотографу » Химия для фотографа » Краткие сведения по химииВода, ее свойства и растворыСвойства воды зависят от ее происхождения. Для приготовления фотографических растворов годится питьевая вода, т. е. прозрачная, бесцветная, без привкуса и запаха. Но всеми перечисленными признаками обладает и жесткая вода. Общая жесткость воды обусловливается присутствием в ней солей кальция, магния, железа и др.
Кипячением воды устраняется временная жесткость, или карбонатная, так как при нагревании растворимые кислые углекислые соли кальция и магния превращаются в нерастворимые карбонатные соли, которые выпадают в осадок и образуют накипь на стенках сосудов. Этот процесс можно записать уравнением: 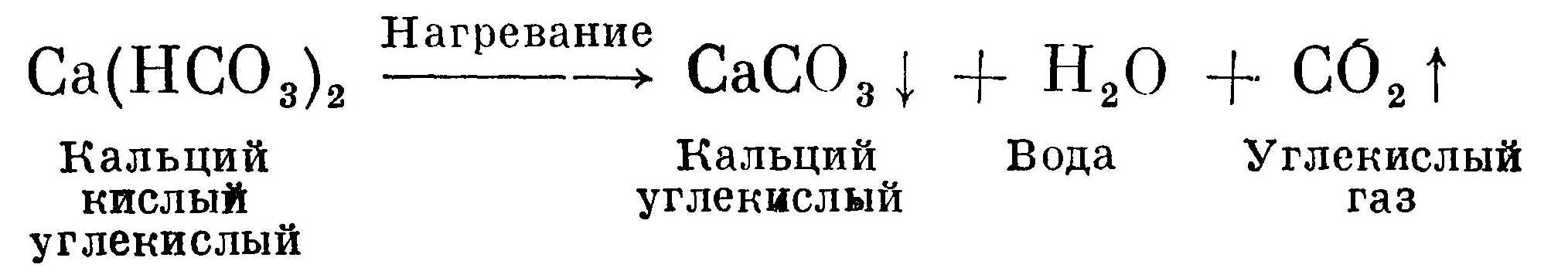 Стрелка вниз показывает, что соединение выпадает в осадок. Стрелка вверх обозначает, что соединение улетучивается, т. е. оно газообразно (в нашем примере углекислый газ).
Процесс выпадения в осадок при кипячении кислой углекислой соли магния идет по более сложной реакции: 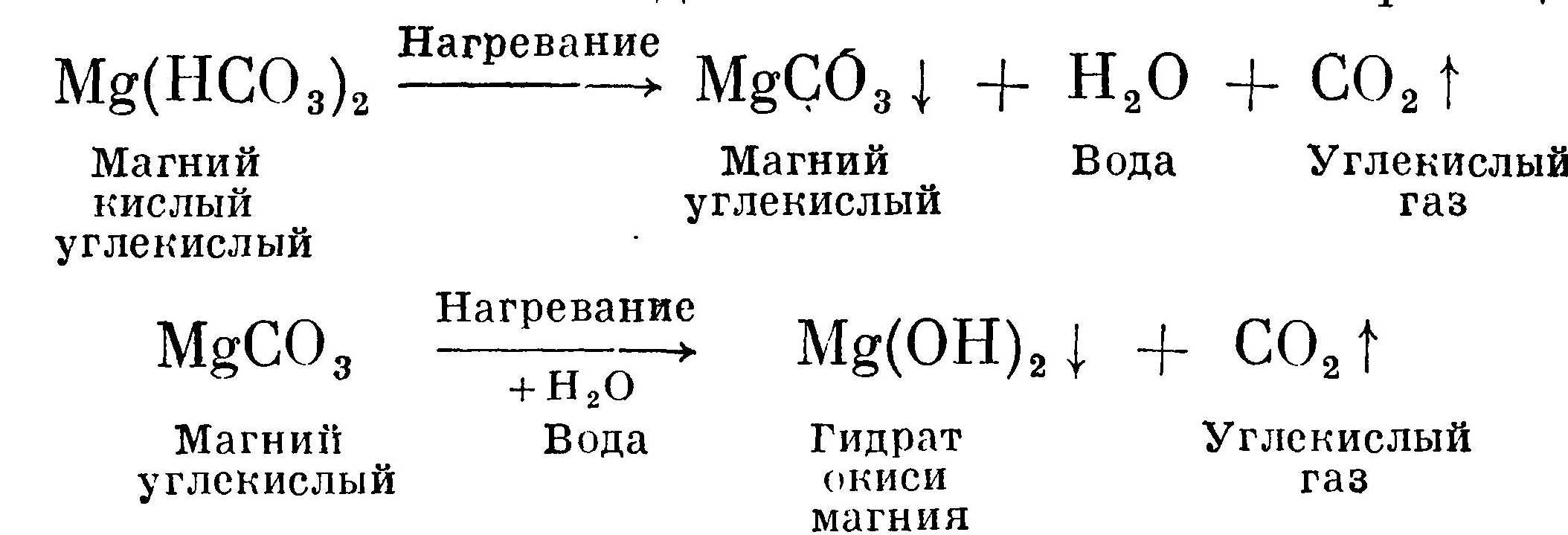
Обращение с химикатами и растворамиМногие химикаты чувствительны к свету, кислороду, углекислому газу и к воде. Поэтому хранить химикаты лучше всего в герметически закрытых сосудах из коричневого стекла, в сухом и прохладном помещении. Сосуды можно закрывать резиновыми, корковыми или полиэтиленовыми пробками, а также притертыми стеклянными пробками, кроме особо оговоренных случаев. Завинчивающиеся пластмассовые пробки должны иметь прокладки для герметизации.
Сосуды с широким горлом предназначены для твердых химикатов; сосуды с узким горлом — для жидкостей и растворов. Бутылки с растворами лучше всего закрывать резиновыми пробками или колпачками. Если бутыль заполнена жидкостью, то вставленная пробка выталкивается сжатым воздухом. Для предотвращения выталкивания пробки ее привязывают крепкой бечевкой, как это показано на рис. 3. 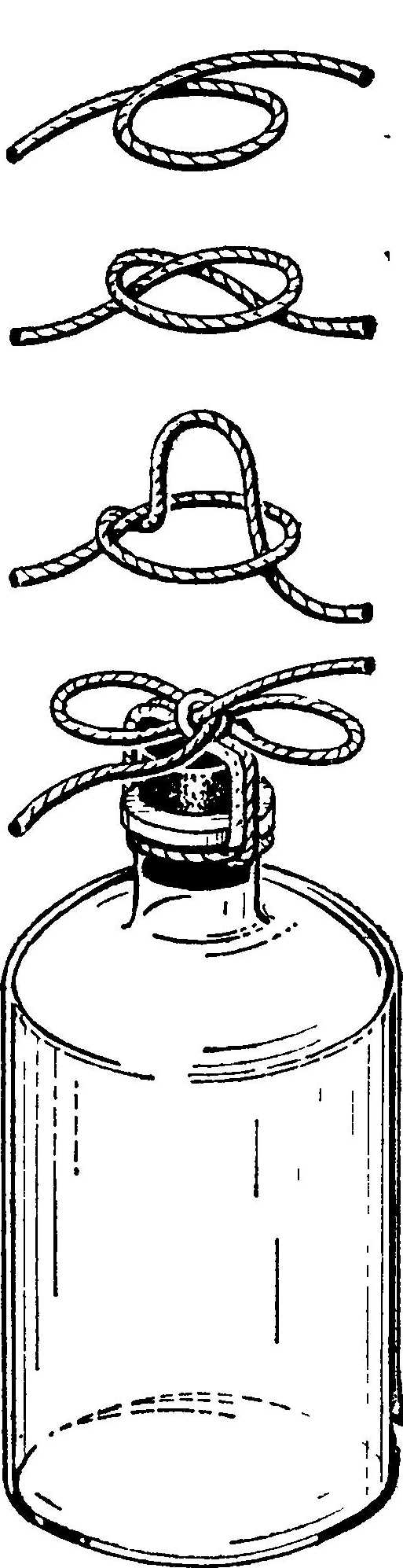 Рис. 3. Пример крепления пробки бечевкой для предупреждения выталкивания ее сжатым воздухом
Приготовление и фильтрация растворовВ фотографической практике используется много растворов. Поэтому для избежания путаницы следует приготовлять каждый раствор отдельно.
Сначала надо выписать на листок рецепт и проверить, не пропущена ли какая-либо его составная часть. При необходимости следует произвести пересчет на соответствующий объем раствора. Сделать навески химикатов, делая пометки в рецепте. Например, требуется составить 1200 мл проявителя следующего состава: Сульфит натрия безводный ......50 г ........60 г Амидол..................................5 г.......... 6 г Бромистый калий.....................2 г.........2,4 г Вода...................................до 1 .....до 1,2 л
Мытье посуды и ее хранениеРекомендуется взять за правило не оставлять растворы без надобности в бачках и кюветах на продолжительное время, потому что на их стенках осаждаются продукты реакции, загрязняющие бачки и кюветы. После окончания работы посуду следует промыть щеткой, мочалкой или поролоновой губкой. Последняя очень практична.
Спирали бачков периодически надо промывать теплой водой со щеткой, так как в канавках образуются наросты от так называемой эмульсионной бахромы. Прилипшая к эмульсии бахрома часто бывает причиной порчи негативов. На внутренних стенках банок из-под растворов со временем появляются опалесциру-ющие налеты. Это либо известковые отложения, либо серебро. 
Основные понятия атомно-молекулярной теорииХимия — наука о веществах, их свойствах, превращениях и способах управления этими превращениями. Теоретическую основу химии составляет атомно-моле-кулярное учение, основы которого были высказаны еще М. В. Ломоносовым и впоследствии развиты А. Лавуазье, Д. И. Менделеевым и другими учеными. Вещества состоят из молекул. Молекулами называют наименьшие частицы вещества, сохраняющие его химические свойства. Молекулу можно рассматривать как предел дробления вещества. При химических реакциях одни молекулы разрушаются, а вместо них образуются другие. Молекулы веществ состоят из еще более мелких, химически неделимых частиц — атомов. Каждый вид атома называется химическим элементом, которому присвоен свой символ (Символы, которыми сейчас пользуются, были введены шведским химиком Й. Берцелиусом в 1818 году.). Атомы разных элементов и веществ отличаются массой, размерами и другими свойствами. Масса атома, выраженная в условных единицах, называется атомным весом, а масса молекулы — молекулярным весом. Атомы и молекулы находятся в движении. Одна из форм движения атомов — химическая реакция. Химическая реакция — явление, в результате которого из атомов, составляющих молекулы исходных веществ, образуются молекулы новых веществ. Химические реакции сопровождаются различными физическими явлениями: изменением физического состояния веществ, излучением света, выделением или поглощением тепла. При помощи символов химических элементов составляются химические формулы. Химическая формула — изображение состава молекулы вещества посредством символов химических элементов, входящих в состав молекулы. Химическая формула вещества показывает, из каких элементов состоит вещество, сколько атомов каждого элемента содержится в молекуле, в каком весовом соотношении элементы входят в состав вещества, каков молекулярный вес вещества.
Диссоциация солей, кислот и оснований. Кислотность их растворовРазличные соли, кислоты и основания при растворении в воде диссоциируют (распадаются) на ионы. Ион — заряженная отрицательно или положительно составная часть вещества. Положительно заряженный ион называется катионом, так как при пропускании через раствор постоянного тока он движется к катоду (отрицательному электроду). Отрицательно заряженный ион называется анионом по той же аналогии.
Кислота диссоциирует на катион водорода Н' и кислотный остаток — анион: 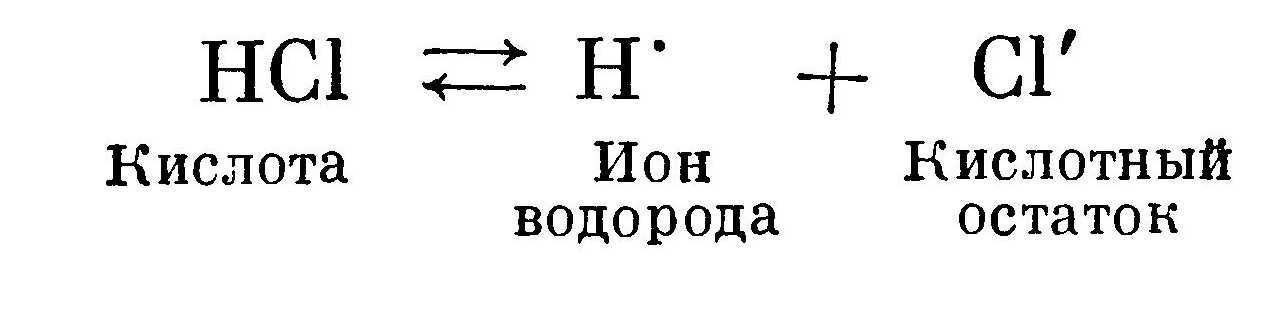 Стрелки указывают на то, что реакция идет в обоих направлениях.
Основание диссоциирует на катион и гидроксильную группу ОН': 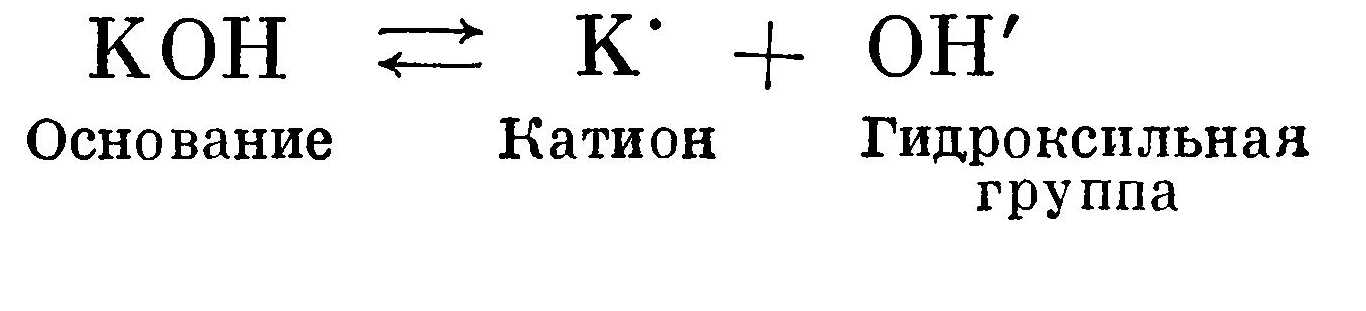 Соль диссоциирует на катион металла (или какой-либо положительный ион) и кислотный остаток:
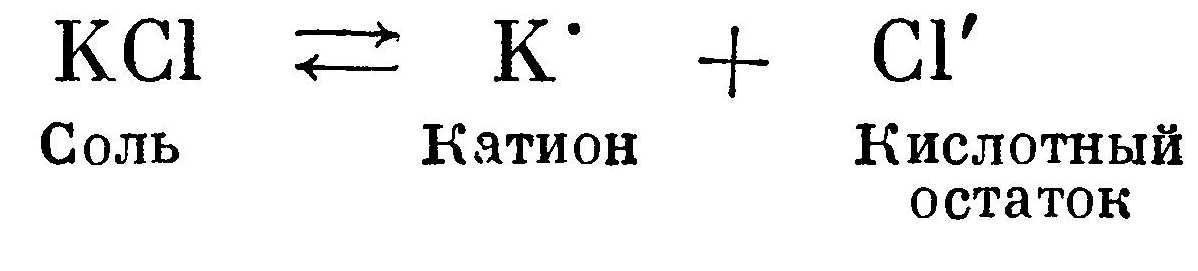
Кислоты, основания, соли и гидролиз солейКислотами называют соединения, которые в водных растворах дают в качестве катиона только положительно заряженный ион водорода. Кислотным остатком является анион — отрицательно заряженный ион. Кислотный остаток — соединение неметаллическое, в большинстве случаев в его состав входит кислород. Исключение составляют кислотные остатки галогенидных кислот (HCl, НВr и т. д.) и синильной кислоты HCN. Чем больше концентрация водородных ионов в растворе, тем сильнее кислота. Сильные кислоты в водных растворах диссоциируют практически полностью. Водные растворы слабых кислот, кроме того, имеют частично диссоциированные молекулы и совершенно недиссоцииро-ванные молекулы. Например, раствор борной кислоты Н3ВO3 содержит катионы водорода Н , кислотные остатки ВO'''3, НВO''3, Н2ВO'3 и недиссоциированные молекулы Н3В03. Причем полностью диссоциированных молекул очень мало. Следовательно, в растворе борной кислоты мала концентрация водородных ионов. Чем больше концентрация водородных ионов в растворе, тем сильнее кислота и соответственно меньше величина рН раствора. К сильным кислотам относятся соляная НСl, азотная HNO3, серная H2SO4; к слабым кислотам — сернистая H2SO3, угольная Н2СO3, ортофосфорная Н3РO4, борная Н3ВO3, а также большинство органических кислот.
Гидролиз карбоната натрия и Сульфит натрияГидролиз карбоната натрия Na2CO3.
Соль получена в результате реакции взаимодействия между сильным основанием NaOH и слабой кислотой Н2СO3. Сама по себе соль
нейтральна, так как она не содержит ни одного атома водорода или гидроксила. В растворе соль диссоциирует на ионы Na' и С03. Вода также диссоциирована на ионы Н' и ОН', но число их одинаково и реакция нейтральная: 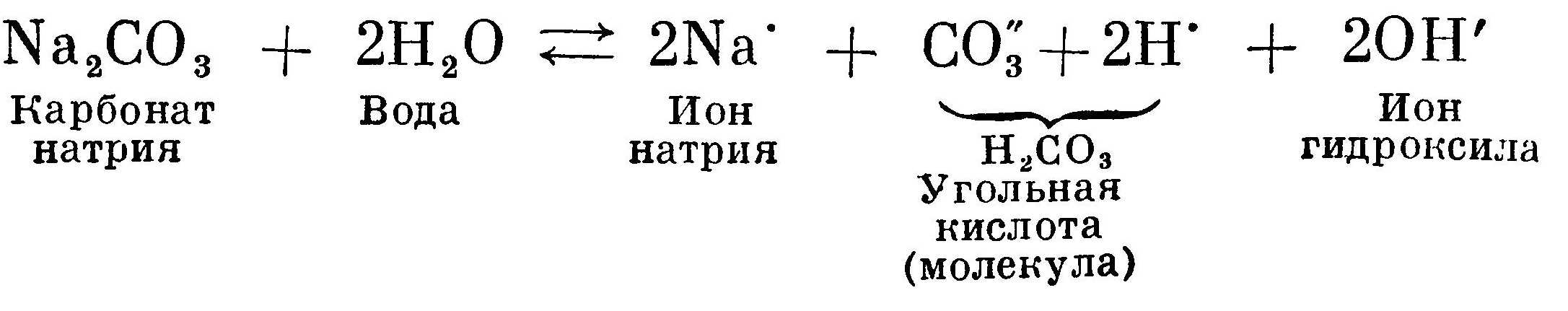
Определение величины рН раствораВеличина рН раствора может быть определена различными способами. Заметим, что определение величины рН, а также титрование раствора требуют соответствующих навыков в работе, аккуратности и точности со стороны исполнителя. Индикаторы — органические цветные вещества, которые меняют свой цвет с.изменением концентрации водородных ионов в том растворе, в который они добавлены. Поэтому можно рекомендовать только самые простые индикаторы: многоцветные индикаторные бумаги. Для определения рН раствора полоску цветной индикаторной бумаги смачивают раствором. После этого наблюдают окраску среднего широкого контрольного поля. Величина рН раствора определяется по соответствующему полю сравнительной шкалы. На рис 2 изображен образец многоцветной индикаторной бумаги, а в табл. 3 даны количественные характеристики индикаторной бумаги ФАН.
Химикаты для фотографических растворовКаждому веществу можно дать характеристику по его внешнему виду, растворимости в воде, основным химическим свойствам и области применения, а также степени чистоты. Химические вещества разделяются на четыре группы по чистоте: чистые — Ч, чистые для анализа — ЧДА, химически чистые — ХЧ и особой чистоты — ОСЧ. Для фотографических растворов вполне достаточен продукт марки Ч. Химикаты марки «Фото» специально предназначены для фотографических растворов. Они должны быть очищены от вредных примесей, влияющих на качество изображения. По форме химические вещества весьма разнообразны: кристаллические, гранулированные, порошкообразные. Некоторые вещества могут быть в двух состояниях! кристаллическом ибезводном. Например, сода кристаллическая и сода безводная. Поскольку кристаллизационная вода входит в состав молекулы вещества, то кристаллического вещества берется соответственно больше, чем безводного.
|
 Опрашиваем фотографов Опрашиваем фотографов
 Популярные материалы Популярные материалы
|
Загрузка. Пожалуйста, подождите...

