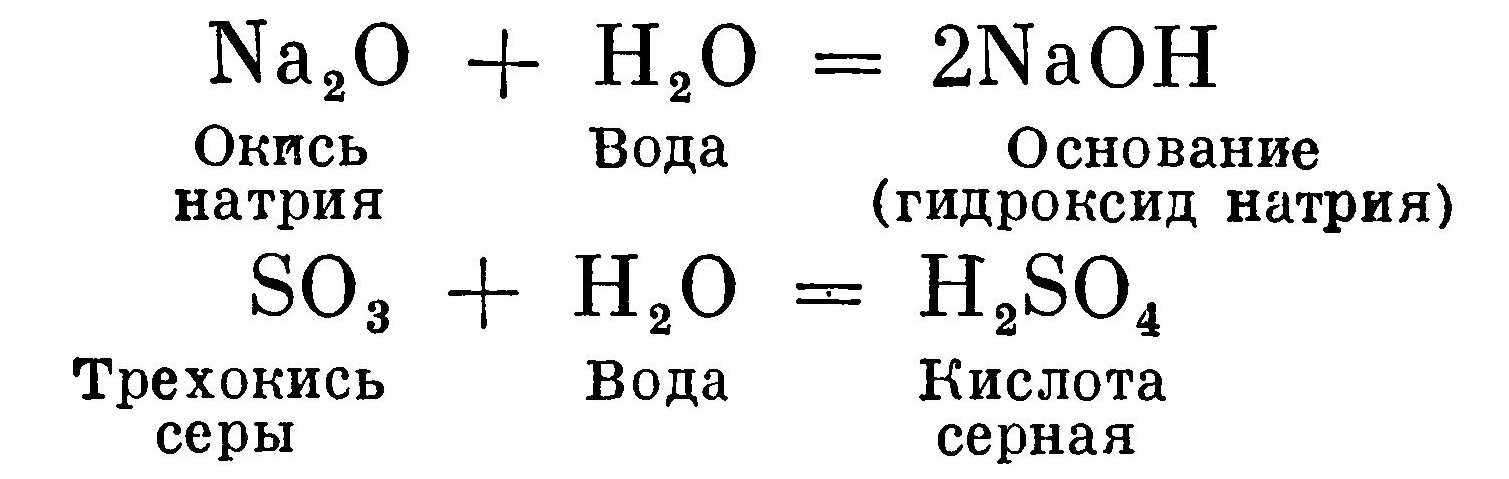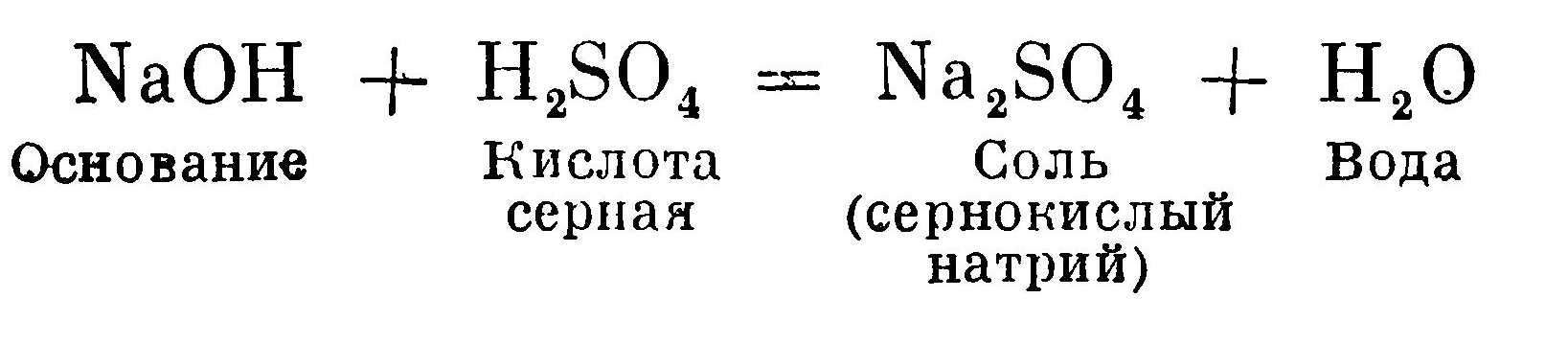 Химия для фотографа Химия для фотографа
|
Профессиональному фотографу » Химия для фотографа » Краткие сведения по химии » Основные понятия атомно-молекулярной теорииОсновные понятия атомно-молекулярной теорииХимия — наука о веществах, их свойствах, превращениях и способах управления этими превращениями.
Теоретическую основу химии составляет атомно-моле-кулярное учение, основы которого были высказаны еще М. В. Ломоносовым и впоследствии развиты А. Лавуазье, Д. И. Менделеевым и другими учеными. Вещества состоят из молекул. Молекулами называют наименьшие частицы вещества, сохраняющие его химические свойства. Молекулу можно рассматривать как предел дробления вещества. При химических реакциях одни молекулы разрушаются, а вместо них образуются другие. Молекулы веществ состоят из еще более мелких, химически неделимых частиц — атомов. Каждый вид атома называется химическим элементом, которому присвоен свой символ (Символы, которыми сейчас пользуются, были введены шведским химиком Й. Берцелиусом в 1818 году.). Атомы разных элементов и веществ отличаются массой, размерами и другими свойствами. Масса атома, выраженная в условных единицах, называется атомным весом, а масса молекулы — молекулярным весом. Атомы и молекулы находятся в движении. Одна из форм движения атомов — химическая реакция. Химическая реакция — явление, в результате которого из атомов, составляющих молекулы исходных веществ, образуются молекулы новых веществ. Химические реакции сопровождаются различными физическими явлениями: изменением физического состояния веществ, излучением света, выделением или поглощением тепла. При помощи символов химических элементов составляются химические формулы. Химическая формула — изображение состава молекулы вещества посредством символов химических элементов, входящих в состав молекулы. Химическая формула вещества показывает, из каких элементов состоит вещество, сколько атомов каждого элемента содержится в молекуле, в каком весовом соотношении элементы входят в состав вещества, каков молекулярный вес вещества. Например, химическая формула сульфита натрия кристаллического записывается символами: Na2S03·7H20. Одна молекула кристаллического сульфита натрия включает в себя: 7 молекул кристаллизационной воды и 1 молекулу собственно сульфита натрия. В свою очередь молекула сульфита натрия состоит из 2 атомов натрия, 1 атома серы и 3 атомов кислорода. Складывая атомные веса составных элементов молекулы, получают молекулярный вес вещества. Так, молекулярный вес сульфита натрия равен 23*2+32,1 + 16,3=126,1. Вес 7 молекул воды — (1*2+16)х7 =126. По весовому соотношению сульфита натрия и кристаллизационной воды ( 126,1/126 ≈ 1/1) видно, что они равны. Значит, половина веса кристаллического сульфита натрия приходится на кристаллизационную воду. Количество граммов вещества, численно равное атомному или молекулярному весу, называется грам м-а т о-м о м или грамм-молекулой этого вещества. В грамм-атоме любого элемента содержится одно и то же число атомов. Пользуясь понятиями «грамм-атом» и «грамм-молекула», можно производить различные вычисления по химическим формулам и уравнениям. Нужно, однако, помнить, что под символом элемента можно понимать не только атом и атомный вес элемента, но и его грамм-атом, а под формулой вещества — и его грамм-молекулу. Для справок в табл. 1 приведены округленные атомные веса важнейших элементов. Символы расположены в алфавитном порядке. Химические вещества, состоящие из молекул, образованных атомами различных элементов, называются сложными химическими веществами; они разделяются на органические и неорганические вещества. Таблица 1 Атомные веса важнейших элементов
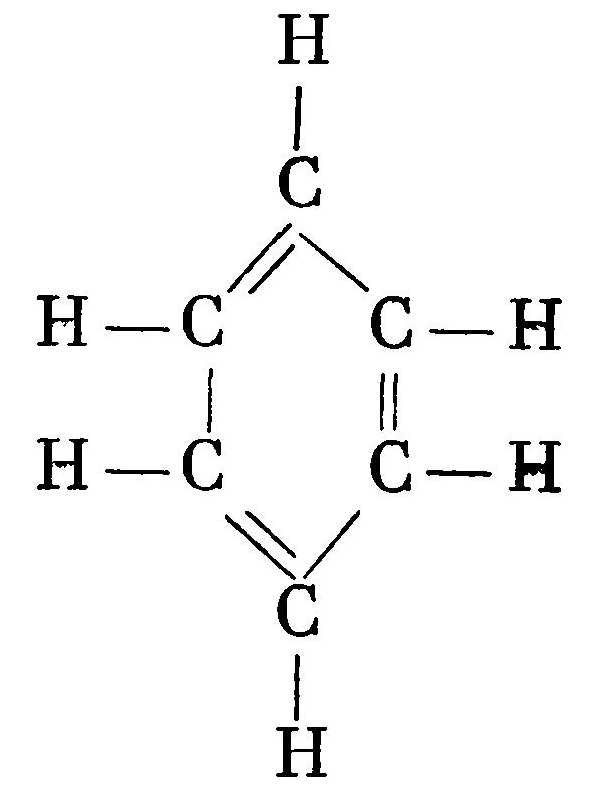
К органическим веществам относятся многочисленные соединения углерода. Большинство из них содержат водород. Их называют углеводородами. Часто в состав углеводородных соединений входят азот, кислород, сера, галогениды и другие элементы. Но основу органических соединений составляют различные виды углеводородных цепочек: прямых, разветвленных, замкнутых и т. п. Например, соединение с прямой углеводородной цепью С8Н18, в основе которой лежит 8 атомов углерода, называется октаном — по числу атомов углерода в цепочке. Структурная формула такой цепочки выглядит следующим образом: 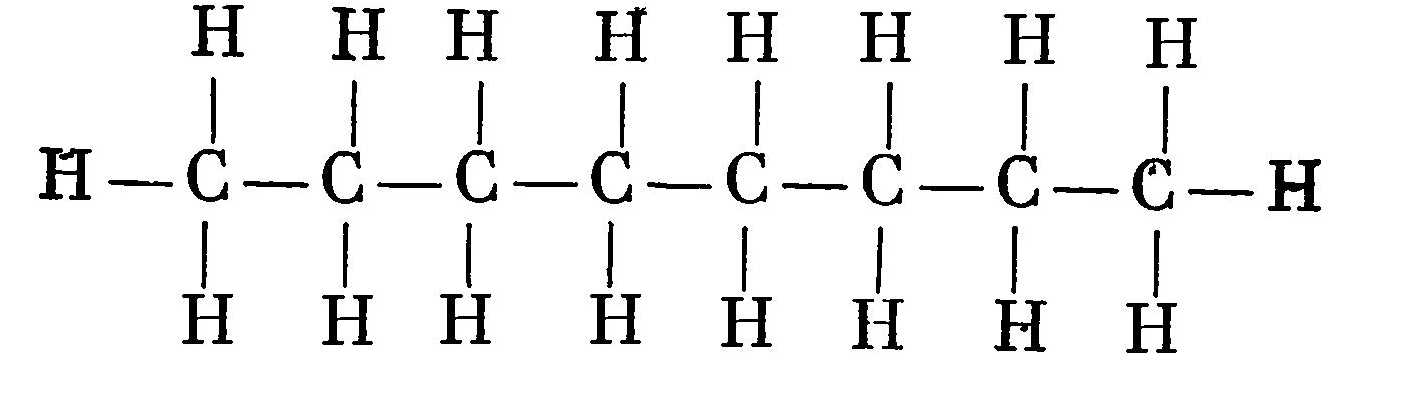 Соединение с замкнутой углеводородной цепью из 6 атомов углерода называется бензолом. Структурная формула бензола выглядит следующим образом:
Вместо полной структурной формулы бензола часто изображают только шестигранник, опуская символы СН, расположенные в каждом его углу.
В результате химических реакций вместо водорода в углеводородную цепочку может быть введен какой-либо другой элемент или группа элементов. Например, если вместо атома водорода в бензол ввести группу — ОН, то может быть получено новое вещество — фенол:
В дальнейшем мы будем пользоваться только краткой формой обозначения углеводородных соединений, как в примере с фенолом. К неорганическим веществам относятся все простые вещества, входящие в периодическую систему элементов Д. И. Менделеева, а также окислы, основания, кислоты, соли и водородные соединения, образованные этими элементами. Все простые вещества делятся на две группы: металлы и неметаллы. Соединение металла или неметалла с кислородом называется окислом. В результате реакции окисла металла с водой получается основание, а окисла неметалла с водой — кислота:
В результате реакции, протекающей между основанием и кислотой, образуются соль и вода:
Существует несколько номенклатур наименований химических соединений. Поэтому одно и то же вещество может иметь несколько названий. Наименование соли составляется из названий кислотного остатка и металла. Часто используются латинские термины. Например, соли угольной кислоты называют карбонатами, соли серной кислоты — сульфатами, соли сернистой кислоты — сульфитами, соли азотной кислоты — нитратами, соли уксусной кислоты — ацетатами и т.д. Мы обратим особое внимание на наименования солей, образованных с кислотными остатками различных кислот серы. Большие неудобства в распознавании солей доставляют такие названия кислотных остатков, как «сернистый», «сернокислый», «серноватистокислый», «сернистокислый» и др. В дальнейшем мы будем называть соль с кислотным остатком S" — сульфид, с кислотным остатком SO"3— сульфит, с кислотным остатком SO"4 — сульфат, с кислотным остатком S2O"3 — тиосульфат, с кислотным остатком HSO'3 — бисульфит, с кислотным остатком HSO'4 — бисульфат.
 Читайте также: Читайте также:
|
 Опрашиваем фотографов Опрашиваем фотографов
 Популярные материалы Популярные материалы
|
Загрузка. Пожалуйста, подождите...