 Химия для фотографа Химия для фотографа
|
Профессиональному фотографу » Химия для фотографа » Краткие сведения по химии » Диссоциация солей, кислот и оснований. Кислотность их растворовДиссоциация солей, кислот и оснований. Кислотность их растворовРазличные соли, кислоты и основания при растворении в воде диссоциируют (распадаются) на ионы. Ион — заряженная отрицательно или положительно составная часть вещества. Положительно заряженный ион называется катионом, так как при пропускании через раствор постоянного тока он движется к катоду (отрицательному электроду). Отрицательно заряженный ион называется анионом по той же аналогии.
Кислота диссоциирует на катион водорода Н' и кислотный остаток — анион: 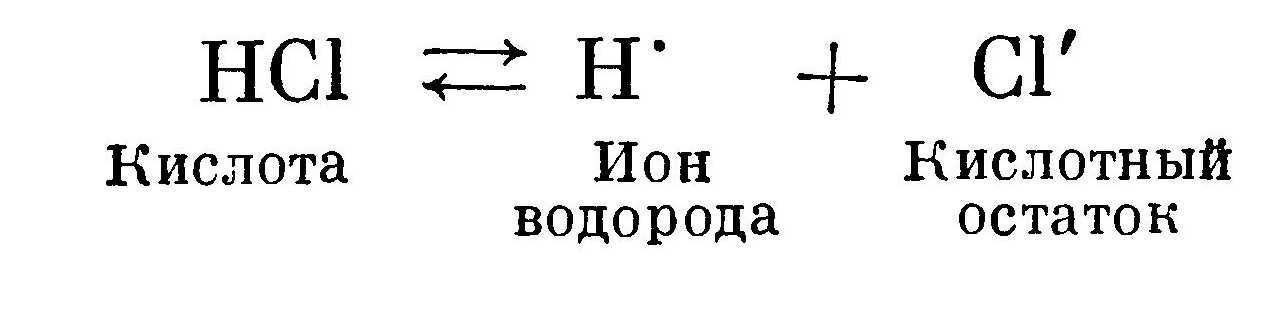 Стрелки указывают на то, что реакция идет в обоих направлениях.
Основание диссоциирует на катион и гидроксильную группу ОН': 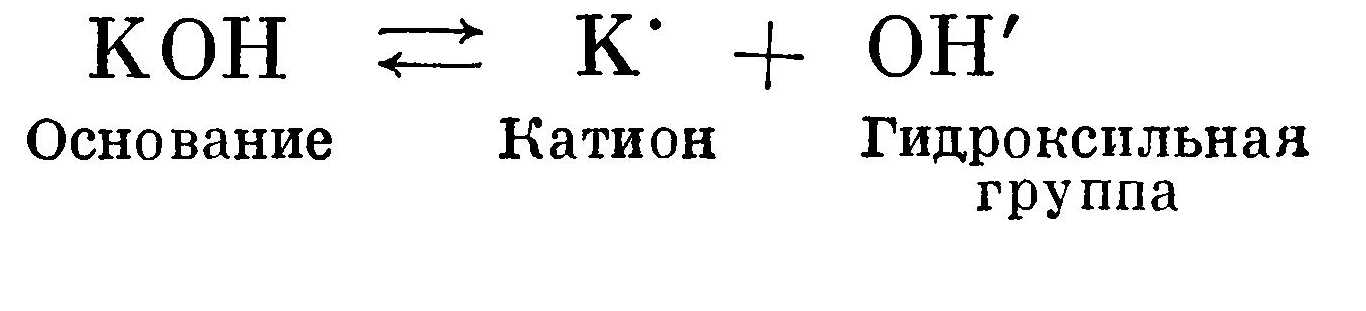 Соль диссоциирует на катион металла (или какой-либо положительный ион) и кислотный остаток:
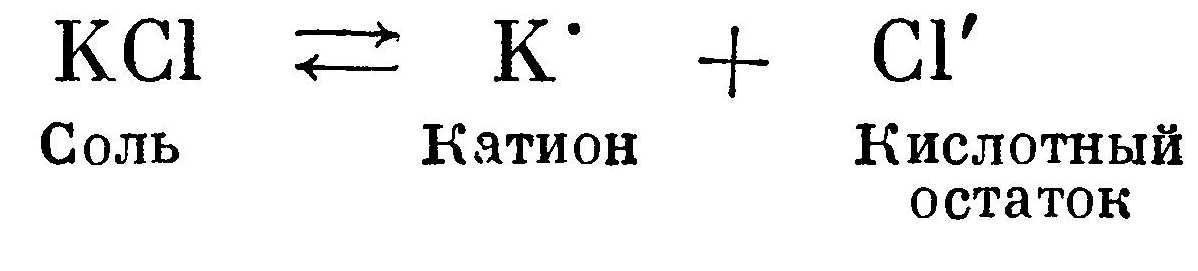 Практически полная диссоциация протекает в растворах сильных кислот, оснований, а также солей, образованных сильными кислотами и основаниями. Диссоциация же слабых кислот и оснований идет в значительно меньшей степени.
Все растворы характеризуются кислотностью, т. е. концентрацией водородных ионов. Изменение концентрации водородных ионов в растворе влияет на фотографические свойства раствора, такие, как скорость проявления, способность проявлять вообще, сохраняемость раствора. Известно, что чистая вода диссоциирует на ионы водорода и гидроксила по уравнению: 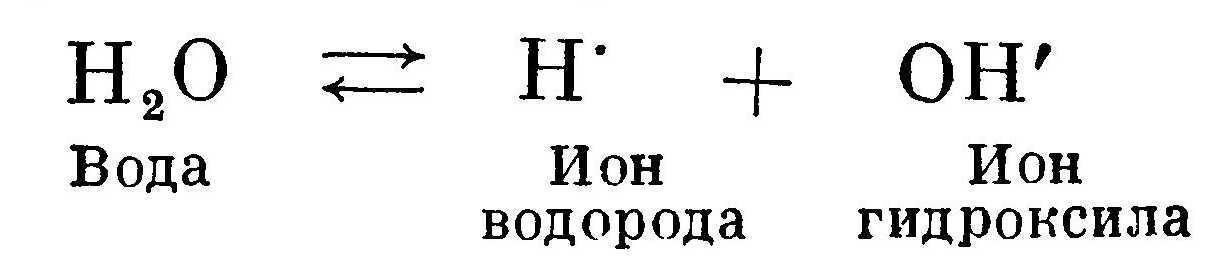 Концентрации ионов водорода и гидроксила в воде одинаковы, следовательно, и реакция всей системы в целом нейтральная.
По величине электропроводности воды было найдено, что концентрация водородного иона составляет 1/10000000 грамм-иона на 1 л. Для удобства пользуются не дробными числами, а десятичными логарифмами с обратным знаком. Например, концентрация водородных ионов [Н'] = 1/10000000 = 10-7. Десятичный логарифм этого числа (lg 10-7 = -7) с обратным знаком равен 7. Концентрация водородных ионов выражается так называемым водородным показателем и обозначается символом рН — сочетание первой буквы слова «pirissance» и символа водорода Н (Выражение концентрации водородных ионов логарифмом дробного числа с обратным знаком было предложено шведским химиком Соренсеном в 1909 году. Свою работу Соренсен написал на французском языке. По-французски слово «логарифм» — puissance.). Для воды рН = 7. Нетрудно проследить, что если концентрация водородных ионов увеличивается, т. е. возрастает абсолютное число их в 1 л раствора, то водородный показатель рН уменьшает- ся. Например, если в воду добавили кислоты и тем самым повысили концентрацию водородных ионов и она стала равна [Н] = 1/1000 = 10-3 грамм-ион на 1 л, то рН = — lg 10-3=3. Среда кислая. Таким образом, по величине водородного показателя можно судить о кислотности (или щелочности) раствора. Если рН меньше 7, то раствор кислый, если рН больше 7, то раствор щелочной. Таблица 2 Ориентировочное значение рН некоторых растворов
 Благодаря тому, что степень диссоциации различных веществ различна, возможно приготовление растворов с различными значениями рН (рис. 1). В табл. 2 приведены значения рН некоторых растворов. 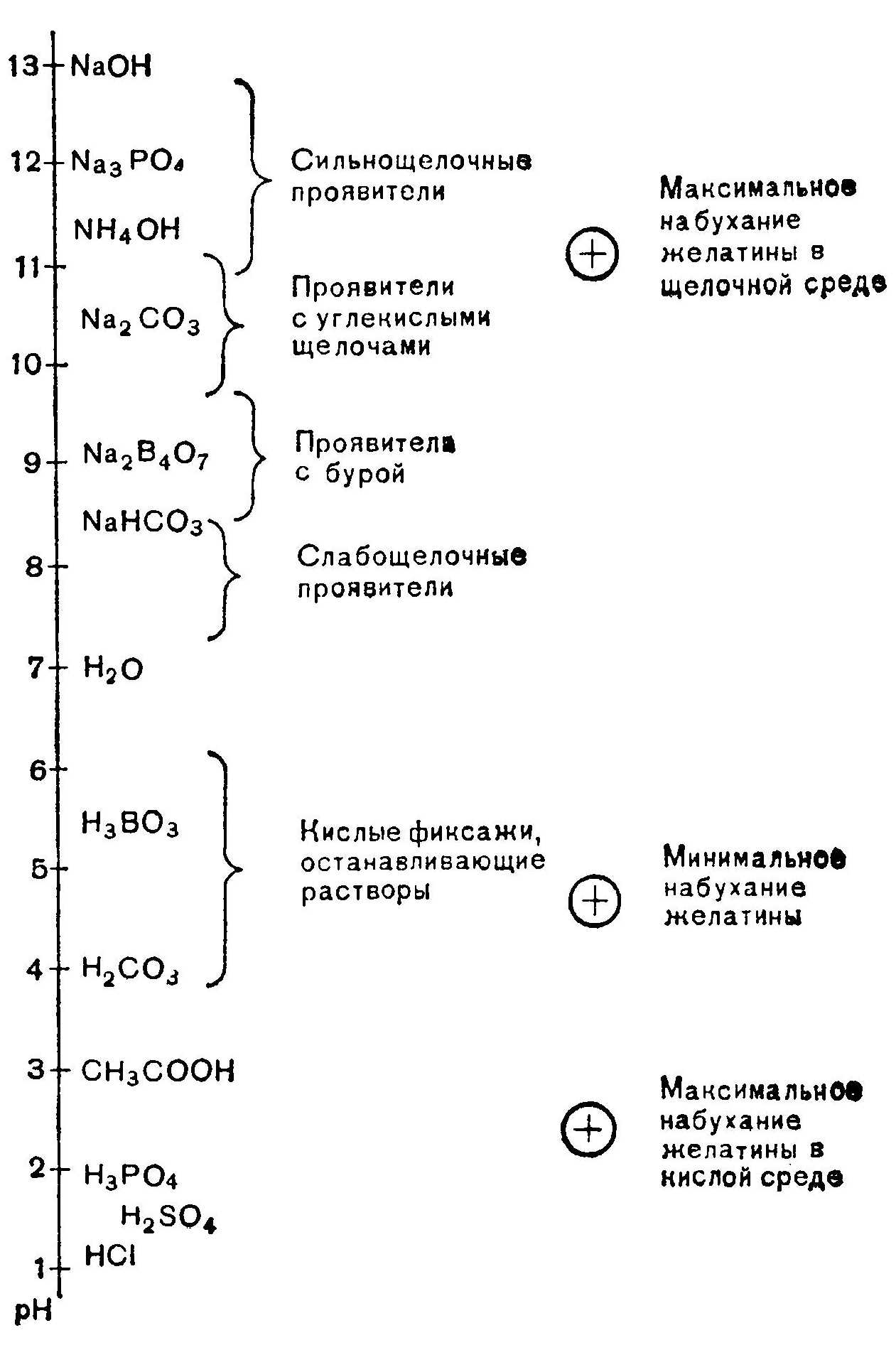 Рис. 1. Ориентировочные значения рН различных фотографических растворов
 Читайте также: Читайте также:
|
 Опрашиваем фотографов Опрашиваем фотографов
 Популярные материалы Популярные материалы
|
Загрузка. Пожалуйста, подождите...

