 Химия для фотографа Химия для фотографа
|
Профессиональному фотографу » Химия для фотографа » Обрабатывающие растворы, проявители » Проявляющий растворПроявляющий растворХимическая сущность проявления очень сложна. Проявитель избирательно восстанавливает (проявляет) те микрокристаллы галогенида серебра, которые несут центры скрытого изображения, возникшие в результате действия света. Проявленное изображение состоит из чистого металлического серебра в случае черно-белого процесса.
Обычные проявители представляют собой растворы, содержащие одно или два проявляющих вещества, а также сохраняющие, ускоряющие и противовуалирующие вещества. Свойства проявителя зависят от его состава, концентрации веществ, температуры раствора, времени и условий хранения проявителя перед его употреблением. Конечные результаты зависят и от условий обработки: способа и продолжительности проявления, перемешивания и условии экспонирования. Проявляющий раствор является сложной системой. Концентрация того или иного вещества в нем предопределяет направление реакции. Химические реакции в растворе идут все время, начиная с момента приготовления проявителя. В процессе участвуют все составные части реакционного объема, вплоть до желатины и воды. В целях упрощения мы рассмотрим химические реакции в определенной последовательности, удобной для выявления роли составных частей раствора. Отметим только, что это основное направление хода процесса. В действительности же в системе идет много параллельных реакций, которые также оказывают существенное влияние на конечный результат. Активным началом в проявителе является проявляющее вещество, которое в процессе проявления окисляется. На примере бромистого серебра и гидрохинона можно написать химическую реакцию: 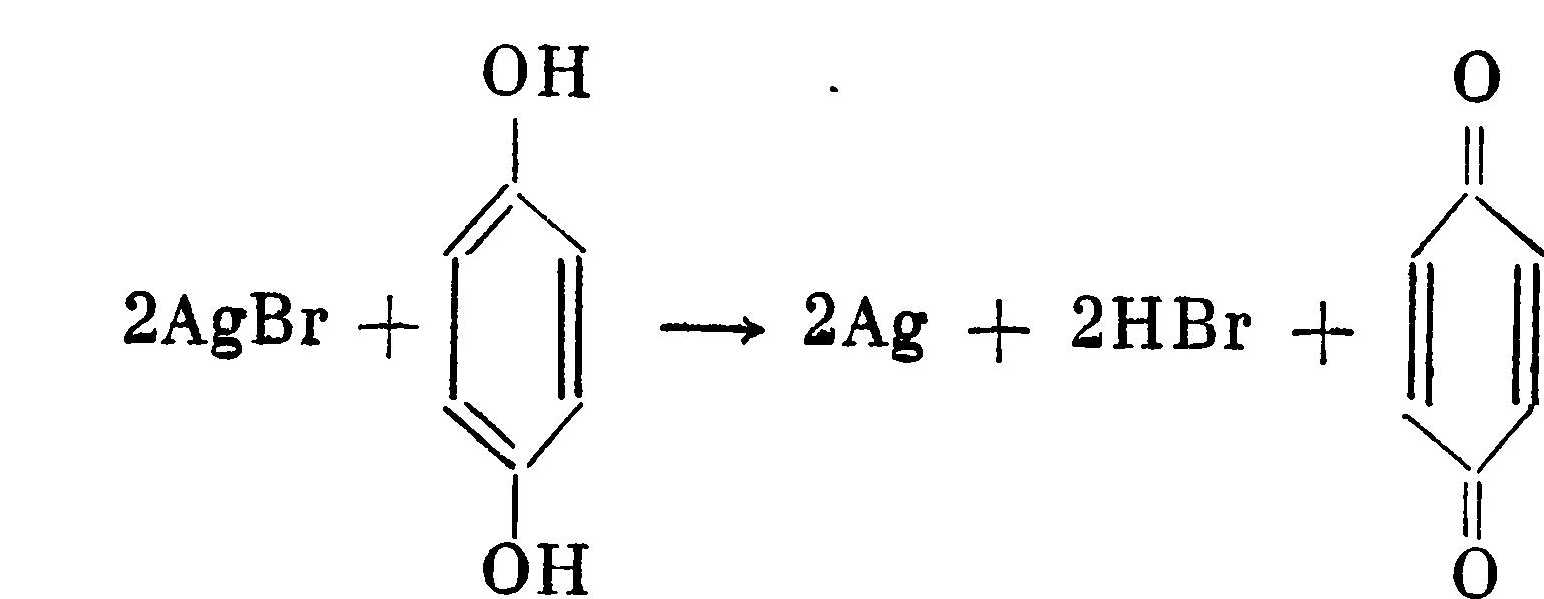 В результате реакции получаются металлическое серебро, кислота и окисленная форма проявляющего вещества.
Присутствующий в растворе сульфит натрия с участием воды восстанавливает окисленную форму проявляющего вещества до моносульфоната с образованием щелочи: 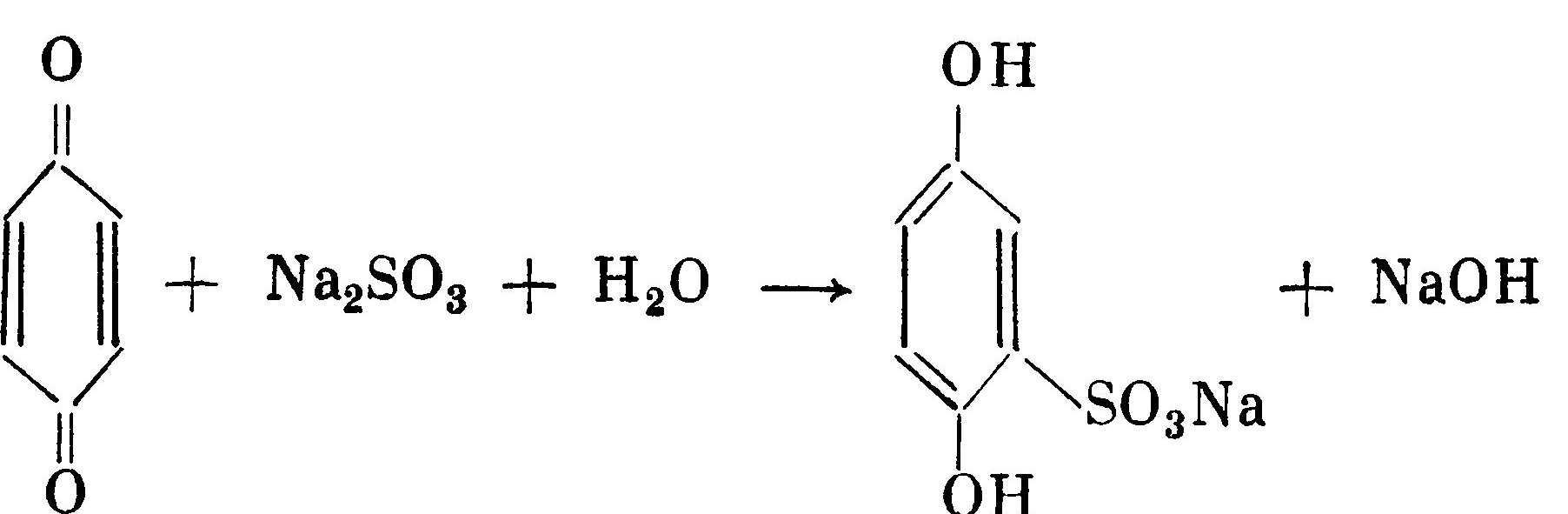 Моносульфонаты (в нашем примере моносульфогидро-хинон) обладают проявляющей способностью, хотя и проявляют менее активно:
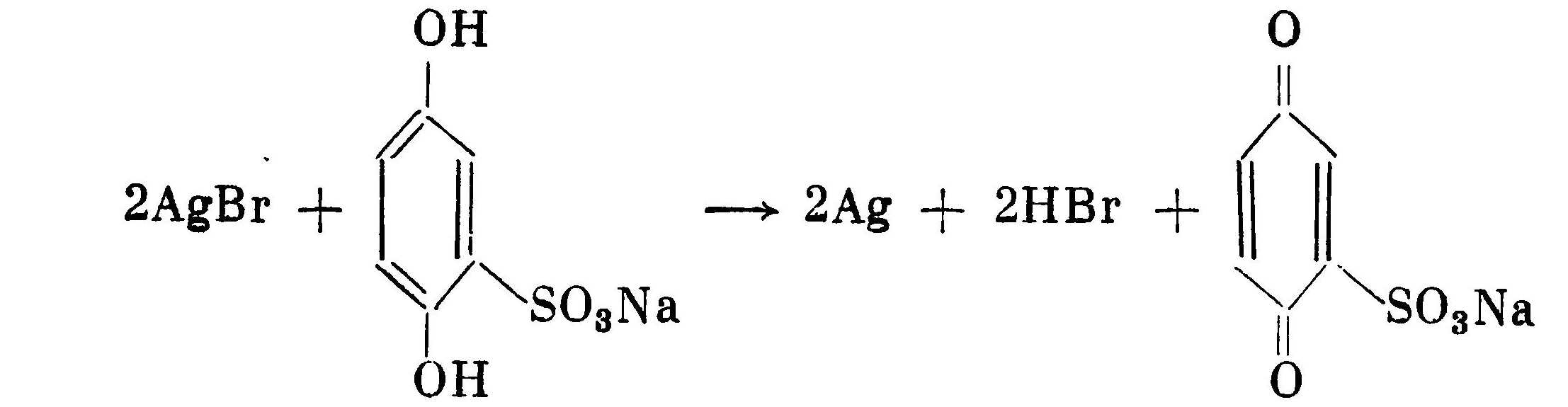 Далее окисленная форма моносульфоната опять восстанавливается сульфитом натрия до дисульфоната, который практически уже не обладает проявляющей способностью. Образующаяся в результате реакции проявления кислота нейтрализуется имеющейся в растворе щелочью: одна половина кислоты нейтрализуется щелочью, полученной в результате восстановления окисленной формы проявляющего вещества, а другая половина кислоты нейтрализуется щелочью, входящей в состав проявителя 2НВr + NaOH + Na2CO3 -> 2NaBr + NaHCO3 + H2O В результате реакции проявления в растворе накапливаются бромиды (соли бромистоводородной кислоты? NaBr, КВr), которые по мере накопления в дальнейшем начинают тормозить проявление.
Кроме основного процесса постоянно идет побочный процесс окисления проявляющего вещества кислородом воздуха с образованием сульфоната проявляющего вещества, сульфата натрия и щелочи: 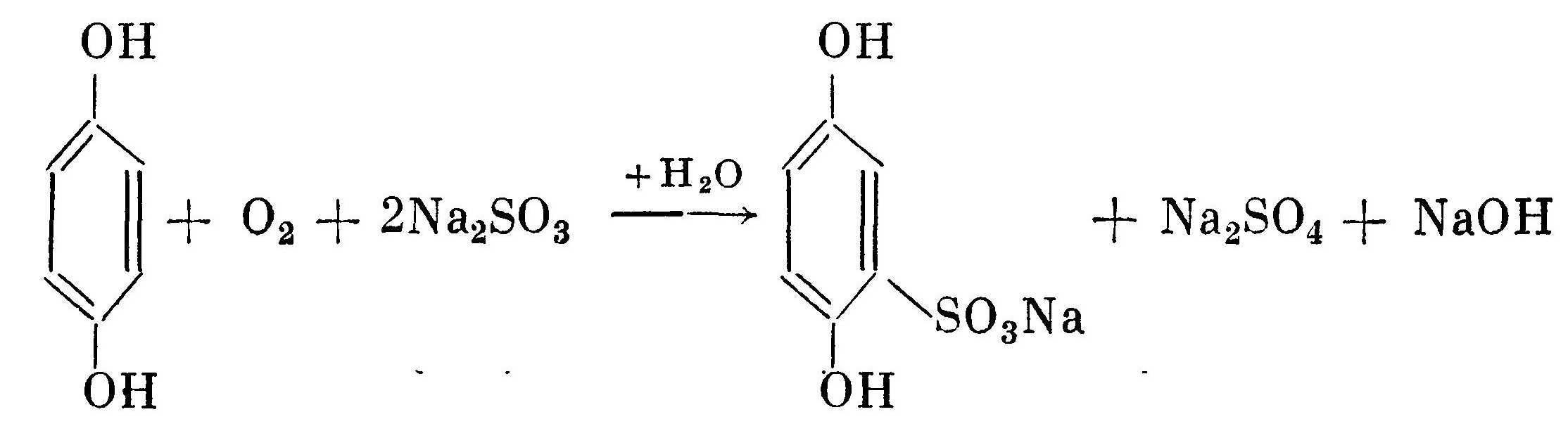 Моносульфонат гидрохинона менее активен. Прежде всего это выражается в том, что он обладает меньшей вуалирующей способностью, чем гидрохинон. Поэтому не рекомендуется использовать свежеприготовленный проявитель. Кроме того, образующаяся щелочь в результате реакции окисления кислородом повышает активность проявителя за счет увеличения рН раствора. Только после перехода большинства гидрохинона в моносульфонат начинается дальнейшее окисление моносульфоната в дисульфонат, который уже практически не обладает проявляющей способностью: 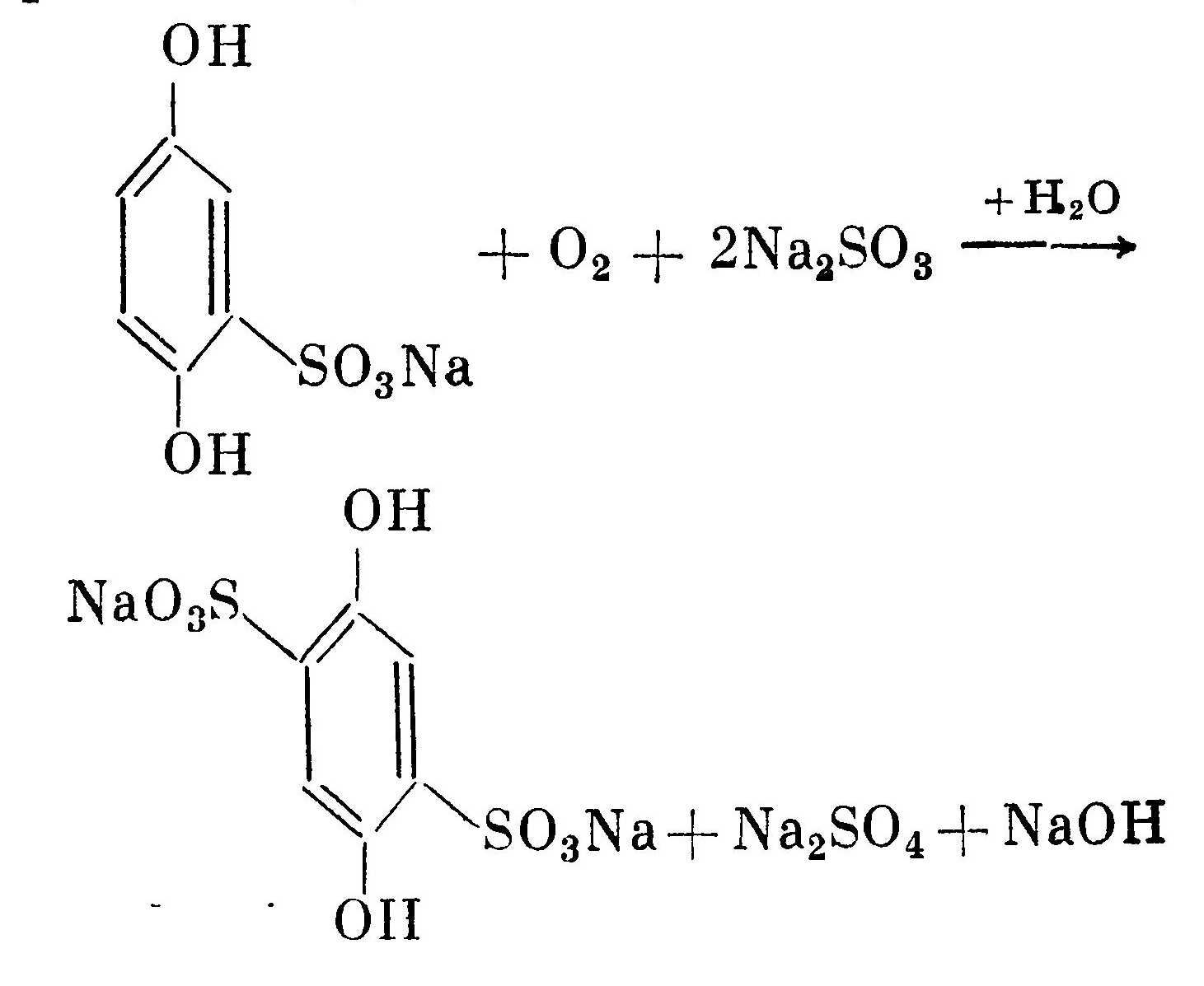 В этом заключается основное отличие окисления проявляющего вещества бромистым серебром и кислородом. В первом случае образование моносульфоната и дисуль-фоната протекает одновременно, а во втором — последовательно. Это также является одной из причин того, что неиспользованные растворы сохраняются дольше, чем частично использованные.
Связывая окисленную форму проявляющего вещества, сульфит натрия препятствует возникновению бурого осадка, состоящего из продуктов полимеризации окисленных форм. Большие концентрации сульфита натрия (100—125 г/л) повышают растворимость галогенида серебра, увеличивая тем самым долю физического проявления, способствуют мелкозернистости изображения. Увеличение концентрат ции сульфита натрия в метоловом проявителе без щелочи ухудшает контурную резкость изображения (Контурная резкость — контраст между деталями изображения, имеющими различные оптические плотности. С увеличением контраста возрастает физиологическое ощущение контурной резкости.). Но сохранность растворов с увеличением содержания сульфита улучшается. Малые концентрации сульфита натрия (до 10 г/л) увеличивают зернистость изображения, улучшают контурную резкость изображения, но одновременно с этим резко сокращают сроки хранения растворов из-за повышенной их окисляемости. С уменьшением концентрации сульфита натрия цвет проявленного изображения смещается в сторону с коричневым оттенком, что благоприятно сказывается при печатании на несенсибилизированные фотоматериалы. Если не принимать во внимание крайних значений концентрации сульфита натрия в проявителе, а также специальных проявителей (инфекционных, дубящих, цветных), то в большинстве случаев концентрация сульфита натрия является мало значащим фактором скорости и качества проявления. В нормальных проявляющих растворах сульфит натрия используется в концентрациях 20—60 г/л. Щелочь и проявляющие вещества можно рассматривать только вместе, потому что они определяют главные свойства проявляющих растворов. Прямое назначение щелочи в проявителе сводится к поддержанию определенного значения рН раствора, потому что активность проявляющего вещества зависит прежде всего от щелочности раствора. Чем выше щелочность раствора (больше значение рН), тем активнее проявитель с органическими проявляющими веществами. Различные проявляющие вещества могут работать в разнообразных пределах рН раствора, от кислой среды до сильнощелочной. Действие проявителя не зависит от химической природы входящей в него щелочи, если рН проявляющего раствора в течение всего времени проявления остается неизменным, а сам эмульсионный слой не оказывает заметного торможения на проникающие в него катионы, например Na, К и др. Каждое проявляющее вещество может работать в определенном интервале рН раствора и имеет характерную для него чувствительность к изменению рН среды. Чем круче кривая зависимости, тем чувствительнее проявляющее вещество к изменению щелочности. Органические проявляющие вещества являются либо слабыми кислотами, либо слабыми основаниями, либо могут быть амфотерными электролитами. Они диссоциируют в водных растворах с образованием избытка соответствующих ионов. Гидрохинон (слабая кислота) диссоциирует с образованием иона водорода и аниона, способного отдать свой электрон при восстановлении галогенида серебра: 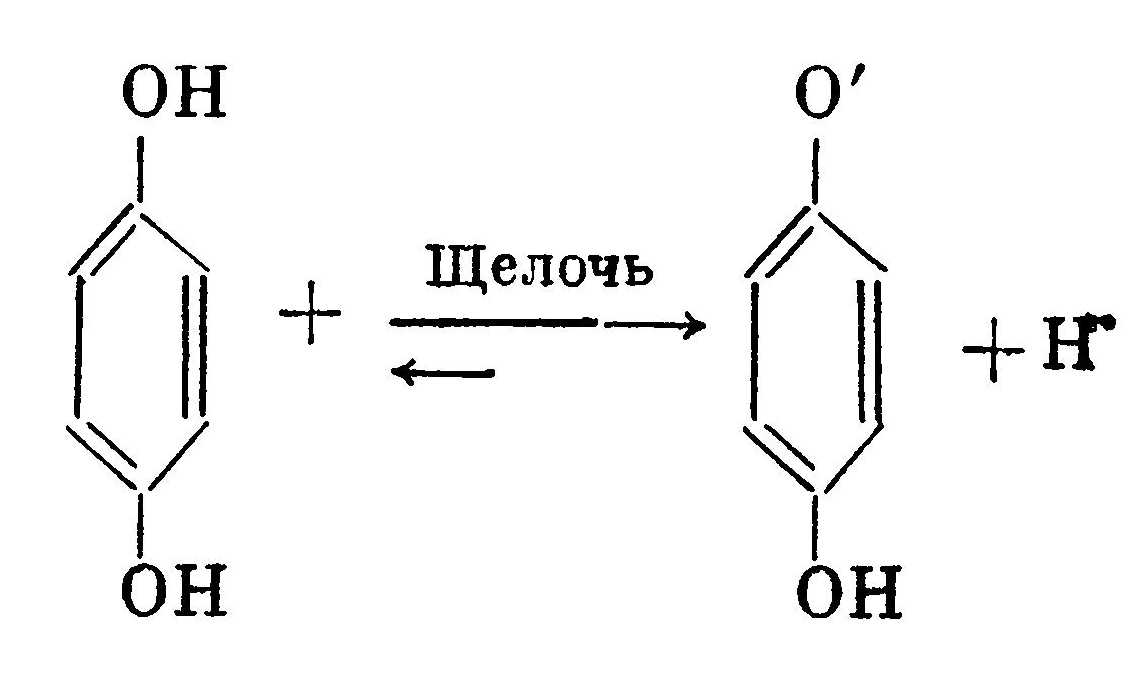 В щелочной среде диссоциация идет дальше с отщеплением второго иона водорода, причем с увеличением щелочности проявляющего раствора диссоциация идет в большей степени.
Парафенилендиамин (слабое основание) при растворении в воде диссоциирует как щелочь с образованием гидроксила и катиона: 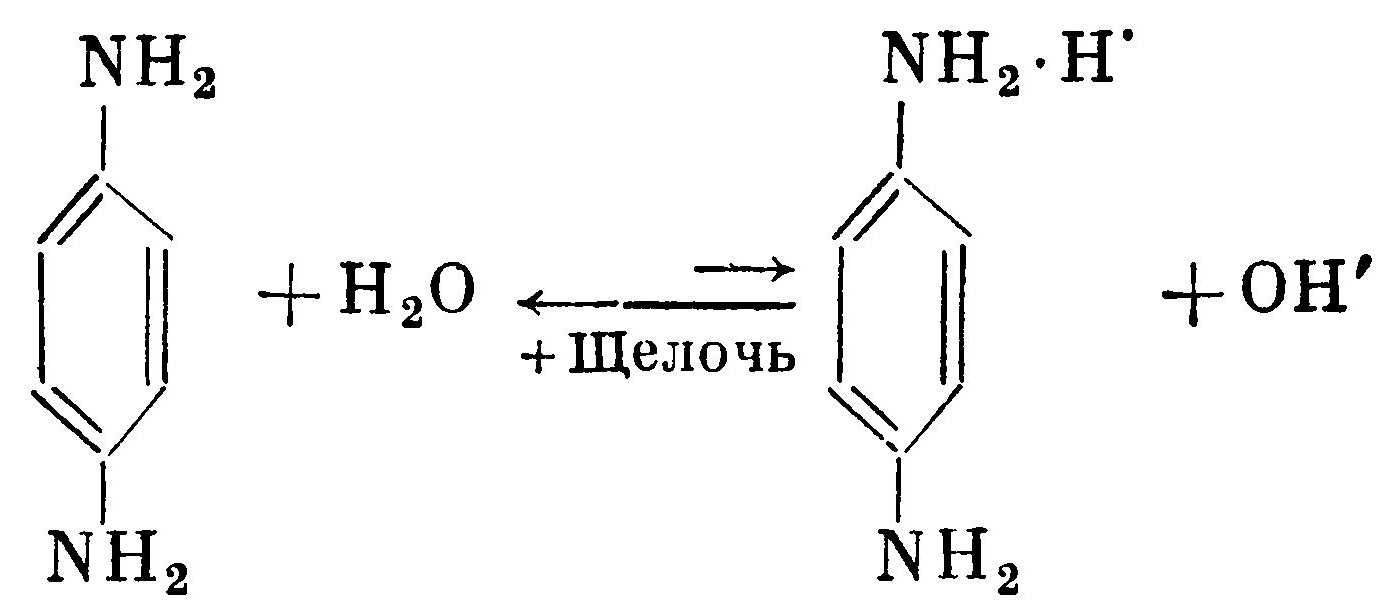 Добавление щелочи к раствору смещает равновесие влево с образованием большего числа недиссоциирован-ных молекул, которые могут легче отдать электрон для восстановления галогенида серебра.
Положительно заряженный ион проявляющего вещества практически не обладает проявляющей способностью, потому что отнять от положительно заряженного иона еще один электрон труднее, чем от нейтральной молекулы. Амфотерные проявляющие вещества в щелочной среде также активнее, чем в кислой. Таким образом, прибавление щелочи к раствору приводит к увеличению концентрации активной формы проявляющих веществ, способных восстанавливать галогенид серебра, а скорость химической реакции пропорциональна концентрации реагирующих веществ. Так как активным началом щелочной среды являются гидроксильные ионы, то совершенно безразлично вещество, поставляющее гидроксильные ионы для создания определенного значения рН раствора при условии неизменности рН в реакционном объеме. Кроме поддержания определенного значения рН раствора и нейтрализации кислоты, образующейся в результате проявления, щелочь также расходуется на оттитрование желатдны эмульсионного слоя до рН проявителя, а также на нейтрализацию кислоты, входящей в состав некоторых проявляющих веществ (сернокислые или солянокислые соли соответствующих оснований). В качестве щелочей для приготовления проявляющих растворов используются: едкие щелочи. (КОН, NaOH), фосфорнокислый натрий трехзамещённый (Na3PO4), углекислые щелочи (К2СO3, Na2CO3, NaHCO3), бораты (бура Na2B4O7, метаборат натрия Na2B2O4). Для каждой щелочи существует некоторая предельная величина рН, которая не изменяется при дальнейшем увеличении концентрации щелочи. Это обусловлено тем, что степень диссоциации электролита уменьшается с увеличением его концентрации. Поэтому для каждой щелочи имеется оптимальная концентрация ее, которая обусловливает максимальную скорость проявления. Например, 4% для соды или 5% для поташа. В забуференных и высокоактивных проявителях применяют высокие концентрации щелочи. В незабуференных (выравнивающих) проявителях используют малые концентрации щелочи или щелочь вообще не вводят. Малые концентрации едких щелочей дают проявители с явно выраженными выравнивающими свойствами. Содержание едких щелочей в проявителях может колебаться от нескольких граммов до 20—30 г/л раствора. Высокие концентрации едких щелочей применяются наряду с высокими концентрациями проявляющих веществ в скоростных энергичных проявителях, где необходимы большие концентрации активных групп проявляющих веществ, получаемых с помощью высоких значений рН раствора. Высокие концентрации щелочи нужны для получения хорошо забуференных растворов. Содержание соды или поташа в проявителях может колебаться от нескольких граммов до 40—50 г/л. Большие количества этих веществ вводят в целях повышения кислотно-основной буферности раствора, где при обработке фотоматериалов требуется постоянство рН раствора, а также с целью уменьшения набухаемости эмульсионного слоя. Например, набухаемость эмульсионного слоя в 15%-ном растворе соды или 10%-ном растворе поташа приблизительно в 5 раз меньше, чем в 5%-ном растворе соды. Бораты применяются в медленноработающих негативных проявителях в концентрациях, равных нескольким граммам на 1 л раствора. В некоторых проявителях вместо щелочи берется формальдегид или ацетон. Эти вещества не обладают щелочными свойствами, но реагируют с сульфитом, образуя при этом сульфитное соединение с выделением едкой щелочи: 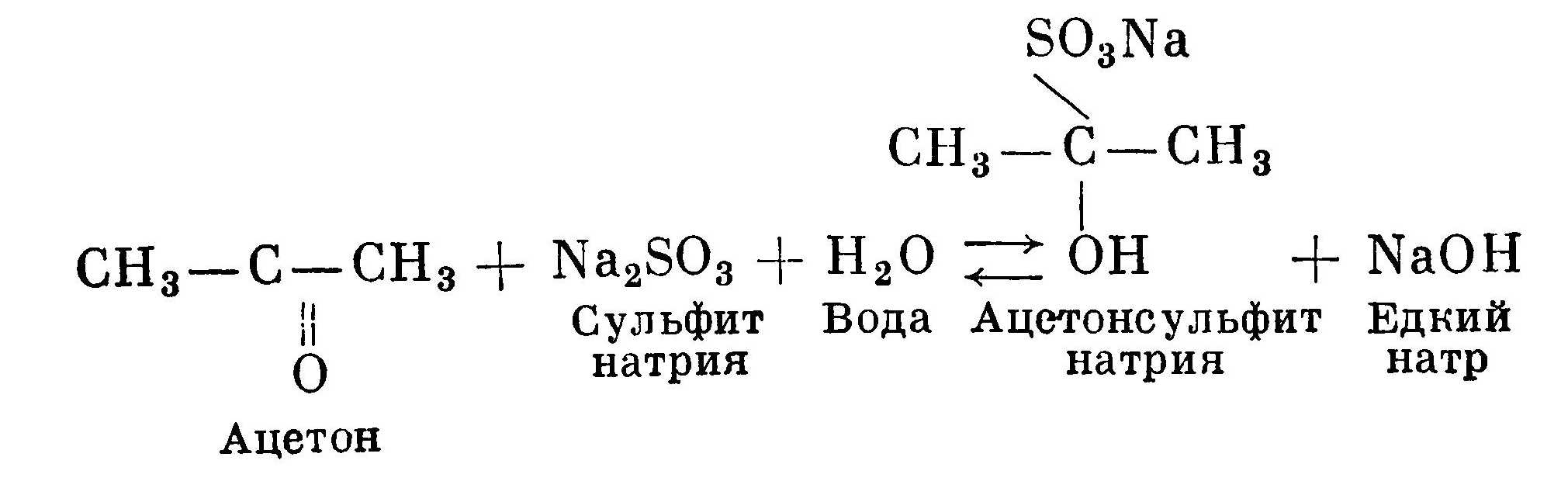 В таких проявителях концентрация сульфита натрия поддерживается на очень низком уровне, кислотно-основная буферность высокая. Эти проявители обычно используются для получения высокого контраста за счет так называемого инфекционного проявления, когда наряду с экспонированным галогенидом серебра проявляются соседние не экспонированные кристаллы семихино-наи. Семихинон не обладает способностью избирательного проявления. Инфекционное проявление наблюдается в проявляющих растворах, не содержащих сульфит или содержащих в очень малых количествах (приблизительно не более 1 %). Вероятно, за счет именно инфекционного проявления получаются грубозернистые изображения, используемые для художественных эффектов. Свойства проявителя также зависят от проявляющего вещества, находящегося в растворе. Очень часто в проявителях используются два проявляющих вещества для придания ему новых качеств. Например, метол в сочетании с гидрохиноном дает более энергичный проявитель. Причем скорость проявления, достигаемая при проявлении в смеси двух веществ, боль- ше суммы скоростей проявления, получаемых при использовании этих веществ порознь. Это свойство называют супераддитивностью. Благодаря высокой супераддитивности действия фенидона в сочетании с гидрохиноном возможно получение активных проявителей при значительно более низких значениях рН, чем в случае метол-гидрохиноновых проявителей, что способствует лучшей сохраняемости и увеличению срока службы растворов. Фенидон обладает также высокой супераддитивностью с моносульфонатом гидрохинона, что немаловажно для поддержания постоянства свойств проявителя. Чем меньше избирательность проявляющего вещества, тем больше его вуалирующая способность. Вуалирующая способность растет с повышением щелочности проявляющего раствора и температуры.
 Читайте также: Читайте также:
|
 Опрашиваем фотографов Опрашиваем фотографов
 Популярные материалы Популярные материалы
|
Загрузка. Пожалуйста, подождите...

