 Химия для фотографа Химия для фотографа
 Секреты фотосъемки Секреты фотосъемки
 Партнеры Партнеры
 Объявления Объявления
» Светочувствительность
Светочувствительность обычно определяется по установленному критерию. Им может быть, например, некоторая величина оптической плотности при заданной степени проявленности. Для численного выражения светочувствительности обычно пользуются обратной величиной экспозиции для получения заданной оптической плотности. Светочувствительность подсчитывается по формуле: S= k/Hkp где S — число светоч ... » Вуаль Вуаль — проявленный неэкспонированный галогенид серебра. Вуаль снижает контраст изображения, и она особенно нетерпима в позитивных изображениях. Для подавления вуали используют неорганические (имеющие ионы брома, йода) и органические соединения (бензотриазол, 6-нитробензимидазол нитрат и др.) Действие противовуалирующих веществ состоит в том, что они образуют труднорастворимые соли серебра, ... » Железо хлорное Железо хлорное, FeCl3·6Н2O. Желто-бурые куски или кристаллы, растекающиеся на воздухе. Очень хорошо растворимо в воде. Растворимость безводной соли 92 г. Водные растворы соли имеют вследствие гидролиза кислую реакцию. Соль находит применение в тонирующих растворах. » Мытье посуды и ее хранение Рекомендуется взять за правило не оставлять растворы без надобности в бачках и кюветах на продолжительное время, потому что на их стенках осаждаются продукты реакции, загрязняющие бачки и кюветы. После окончания работы посуду следует промыть щеткой, мочалкой или поролоновой губкой. Последняя очень практична. Спирали бачков периодически надо промывать теплой водой со щеткой, так как в канав ... » Неподвижная часть камеры (задний ящик) На рис 7 представлена та полоса картона, из которой вы склеите основную часть ящика. Вычертите такую же полосу на своем картоне, точно соблюдая указанные размеры. Прямоугольник с образует верхнюю стенку; два прямоугольника b и b — две боковых стенки; а два прямоугольника o и о, наклеенные один на другой, составят прочное основание. Вы видите, что размеры парных прямоугольников b и b, о ... » Печать на бумаге и картоне Сначала подбираем или изготавливаем негатив черно-белый, желательно крупного (13Х 18 или 24Х 36 см) формата, повышенной контрастности, средней плотности. Поверхность бумаги (картона) может быть гладкой, пористой, структурной, тисненой, матовой или глянцевой. Лучше брать материал с белым цветом поверхности. Перед печатью нужно приготовить светочувствительный раствор, нанести его на бумагу, высушить ... » Типы фотобумаг. Бромосеребряные фотобумаги Светочувствительные эмульсии для фотобумаг в большинстве случаев приготовляют из бромистого серебра, хлористого серебра, смеси бромистого и хлористого серебра, а также смеси йодистого серебра с хлористым или всех трех солей вместе. Химическая природа эмульсии предопределяет свойства фотобумаги, тональность изображения, способность передачи полутонов в светах и тенях. Кроме типа эмульсии, контра ... » Значение фотографии Занятие фотографией у многих превращается в пустую забаву. Это, конечно, очень печально. На фотографию нужно смотреть иначе. Просмотрите иллюстрированные журналы и подумайте над тем, как много они нам дают именно благодаря фотографии. Вот я, сидя где-нибудь в далекой глуши, рассматриваю ряд фотографий, сделанных в полярных льдах участниками экспедиции на „Красине"... Я никогда не был в ... » Обработка цветных фотоматериалы фирмы «Кодак» Цветные обращаемые фотоматериалы фирмы «Кодак» «Эктахром-Х», «Эктахром-HS» тип D и «Эктахром-HS» тип В обычно обрабатывают в фирменных наборах химикатов по процессам Е-3 или Е-4. Процесс Е-3 проводится при температуре растворов 24°С. Процесс Е-4 отличается от процесса Е-3 отсутствием промежуточной засветки, роль которой выполняют специальные вещества — активные неизбирательные восстановит ... » Электрофотография Знаменитый шведский химик И. Я. Берцелиус в 1817 г. открыл элемент селен. В 1873 г. английский инженер-электрик У. Смит и его помощник Дж. Мэй обнаружили возрастание электропроводимости селена под действием света. Впоследствии это явление было названо фотопроводимостью. Позднее ученые установили, что этим свойством обладают и другие вещества. Открытый эффект был положен в основу опытов но регис ... » Хранение фотоматериалов При хранении свойства всех фотографических материалов меняются, и тем скорее, чем выше температура и влажность окружающего воздуха. В свою очередь высокочувствительные фотоматериалы меняют свойства скорее, чем низкочувствительные, а цветные — скорее, чем черно-белые. Изменение свойств заключается прежде всего в увеличении плотности вуали, снижении светочувствительности, уменьшении контрас ... » Элементарные понятия о сенситометрии Сенситометрия — наука об измерении фотографических свойств светочувствительных фотоматериалов. Без знания основ сенситометрии невозможно понимание самой сущности фотографического процесса. Фотографические свойства фотоматериала и влияние на них обрабатывающих растворов всегда можно оценить с помощью характеристической кривой. Характеристическая кривая выражает зависимость между логарифм ... » Стереоскопы, приборы с двумя одинаковыми окулярами Для демонстрации стереопар предназначены стереоскопы, приборы с двумя одинаковыми окулярами (или простыми линзами) и зажимом для стереопары: фото или слайды (рис. 17). Выпускаются также стереоскопы Для демонстрации слайдов на большом экране — стереопроекторы. Они имеют две независимые оптические системы, два одинаковых проекционных объектива, приспособление для синхронного фокусирования ... » Разбавляемые проявители К второй группе относятся так называемые разбавляемые проявители, поскольку рабочие растворы приготовляются путем разбавления высококонцентрированных проявителей с сильной щелочностью. Готовый к употреблению раствор имеет довольно малые концентрации проявляющих веществ и сульфита натрия, но обладает достаточной активностью проявления из-за высокого значения рН. Бромиды, как правило, отсутствуют ... » Печать на пластмассах На органическом стекле, целлулоиде, других пластмассовых материалах, за исключением фторопластов, можно создать и закрепить фотоизображение. Поверхность должна быть чистой и без изъянов. Необходимо приготовить раствор следующего состава: Вода кипяченая, мл 300Белок яичный, мл 30 Двухромовокислый аммоний, г 3 Для защиты от микробов в него добавляем две капли карболовой кислоты, тщательно пере ... » Типы фотобумаг. Тон, поверхность, структура, плотность Цветовой тон изображения должен соответствовать содержанию. Выбор того или иного тона зависит от вкуса фотографа. Сюжеты научно-технического содержания, снежные пейзажи, а также снимки, предназначенные для последующего репродуцирования, рекомендуется делать на фотобумагах, дающих нейтрально-черное изображение на белой подложке. Портреты, архитектуру, летние пейзажи, море, натюрморты предпочтител ... » Гидрохинон, парадиоксибензол Гидрохинон, парадиоксибензол, двухосновная кислота. Белые блестящие кристаллы игольчатого типа. Плохо растворим в холодной воде. С повышением температуры и щелочности проявителя растворимості гидрохинона увеличивается. Начинает проявляті при рН=9,5. Контрастноработающее проявляющее вещество: участки с большими экспозициями проявляются быстро, а участки с меньшими экспозициями проявл ... » Можно ли изготовить черно-белый фотоотпечаток с цветного диапозитива? Да, можно. Для этого сначала изготовляют промежуточный черно-белый негатив, с которого обычным способом печатают на черно-белую фотобумагу. Целесообразнее всего промежуточный негатив получить на ортохроматической стеклянной фотопластинке или листовой фотопленке форматом 9x12 или 13x18 см с помощью фотоувеличителя. Обработку ведут в медленноработающем негативном проявителе. Промежуточный негат ... » Калий Калий бромистый, бромид калия, КВr. Бесцветные мелкие кристаллы, немного гигроскопичные. Растворимость 65,8 г. Применяется как противовуалирующее вещество; входит в состав отбеливающих растворов, где участвует в образовании AgBr из металлического серебра, способствуя тем самым ускорению отбеливания. Калий двухромовокислый, бихромат калия, К2Сr2O7. Большие темно-оранжевые кристаллы, устойчивы ... » Железная соль трилона-Б, мононатриевожелезная соль этилендиаминтетрауксусной кислоты Железная соль трилона-Б, мононатриевожелезная соль этилендиаминтетрауксусной кислоты, Sequestrene NaFe, EDTA-NaFe. В комбинации с тиосульфатом натрия соль дает стойкий отбеливающе - фиксирующий раствор для цветных фотобумаг. При отсутствии готового продукта его можно приготовить из динатриевой соли этилендиаминтетрауксусной кислоты (трилона-Б) и соли трехвалентного железа FeCl3 или Fe2(SO4)3 ... » Растры Растры обычно используют при печати копий на фотобумаге. Они могут значительно видоизменить снимок, сместить смысловой акцент. Технология их применения такова. На один и тот же лист фотобумаги выбранного нами формата, например 24 X 30 см, последовательно под увеличителем экспонируют избранный сюжет и структуру растра (крупное «зерно», симметричный рисунок, текстуру материала и т. и.), ... » Кислотно-основная буферность растворов Скорость многих процессов находится в прямой зависимости от рН раствора. Одни вещества очень чувствительны к изменению рН раствора на десятую долю значения, другие менее чувствительны. На рис. 12 показана зависимость проявляющей способности некоторых веществ от величины рН проявляющего раствора при постоянной экспозиции и постоянном времени проявления. Так, парааминофенол и глицин менее чув ... » Черный бархат Давно замечено, что черные матовые поверхности отражают очень мало падающего на них света. Черный бархат, например,— всего лишь 0,4 %. Если сфотографировать на черно-белую пленку освещенный черный бархат, негатив будет прозрачным, поскольку из-за ничтожно малого отражения света эмульсия сохраняет значительную часть своей чувствительности. Черный бархат считается идеальным не-актиничным фон ... » Бензиловый спирт Бензиловый спирт, С6Н5СН2ОН. Бесцветная жидкость с характерным запахом. Растворимость в воде 4 г. Удельный вес 1,045 г/см3, температура кипения 205°С, показатель преломления 1,54. Находит применение в качестве добавки 3—5 мл на 1 л в цветных проявляющих растворах для проявления фотопленок с защищенными краскообра-зующими компонентами, например фирмы «Кодак». Способствует набуханию и увели ... » Химико-фотографическая обработка фотобумаг Конечной целью фотографирования является позитивное изображение на фотобумаге. Изображение на фотобумаге называется фотоотпечатком. В процессе печатания фотобумагу экспонируют, проявляют, фиксируют, промывают и сушат. С химической точки зрения позитивный процесс аналогичен негативному, но имеет свои особенности. Характерной особенностью изображения, рассматриваемого на фотоотпечатке, являетс ... » Двухрастворные проявители К третьей группе выравнивающих проявителей относятся двухрастворные проявители. По характеру работы они соответствуют действию разбавленного проявителя, но обладают лучшим выравниванием контраста. Поэтому двухрастворное проявление особенно подходит для обработки изображений объектов съемки с большим интервалом яркостей, снятых к тому же на контрастных фотоматериалах. Как правило, 1-й раствор сод ... » Можно ли изготовить черно-белый диапозитив непосредственно с цветного диапозитива? Да, можно. Для этого необходимо произвести контактную или оптическую печать на черно-белый обращаемый фотоматериал и обработать фотоматериал способом обращения либо изготовить черно-белый промежуточ ный негатив, а затем — позитив. Оптическую печать выполнить легче, чем контактную, особенно если требуется изготовить малоформатный негатив. Кроме того, возможна выкопировка только требуе ... » Повышение светочувствительности черно-белых кинофотопленок Нередко фотолюбитель может оказаться в ситуации, когда сюжет интересный, однако черно-белая кино-фотопленка в аппарате слишком малой чувствительности, естественное или искусственное, «подвернувшееся под руку», освещение крайне слабое, настолько, что даже не шевелится стрелка экспонометра (вечером или ночью, например падающий из окна или витрины свет и т. п.), что и останавливает сделать снимок. ... » Дубящие фиксирующие растворы Дубящие фиксирующие растворы применяют преимущественно в жаркое время года во избежание размягчения эмульсионного слоя. В качестве дубящих веществ, как правило, используют алюминиевые или хромовые квасцы. Дубящий фиксаж с хромовыми квасцами обладает большей дубящей способностью, чем фиксаж с алюминиевыми квасцами. В состав дубящих фиксажей входит сульфит натрия, который предотвращает разложени ... » Серная кислота Серная кислота, H2SO4. Тяжелая бесцветная маслопо-добная жидкость с удельным весом 1,84. При разбавлении водой разогревается. Всегда приливать только кислоту в воду, причем небольшими порциями, при осторожном помешивании. В случае попадания брызг кислоты на кожу надо пораженное место обильно промыть водой с мылом или содой.Для предохранения глаз надеть защитные очки. Применяется для приготовления ... |
Профессиональному фотографу » Химия для фотографа » Краткие сведения по химии » Гидролиз карбоната натрия и Сульфит натрияГидролиз карбоната натрия и Сульфит натрияГидролиз карбоната натрия Na2CO3.
Соль получена в результате реакции взаимодействия между сильным основанием NaOH и слабой кислотой Н2СO3. Сама по себе соль
нейтральна, так как она не содержит ни одного атома водорода или гидроксила. В растворе соль диссоциирует на ионы Na' и С03. Вода также диссоциирована на ионы Н' и ОН', но число их одинаково и реакция нейтральная: 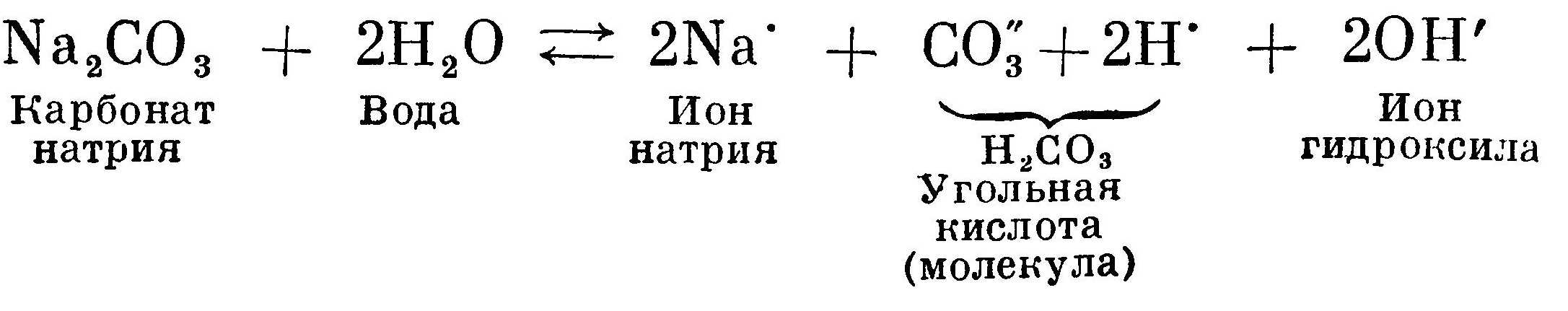 В растворе образуются почти недиссоциированные молекулы угольной кислоты. Тем самым концентрация ионов водорода уменьшается, а концентрация ионов ОН' увеличивается. Реакция становится щелочной за счет избытка ионов гидроксила ОН'. Процесс продолжается до равновесного состояния.
Сульфит натрия Na2SO3 также получен из сильного основания NaOH и слабой кислоты H2SO3. Сернистая кислота H2SO3 сильнее угольной кислоты H2CO3, потому что сильнее диссоциирует. Соответственно она связывает меньшее число ионов водорода, чем угольная кислота. Концентрация ионов водорода в растворе больше, чем в примере с карбонатом натрия. Поэтому раствор сульфита натрия носит менее щелочной характер, чем раствор с карбонатом натрия: 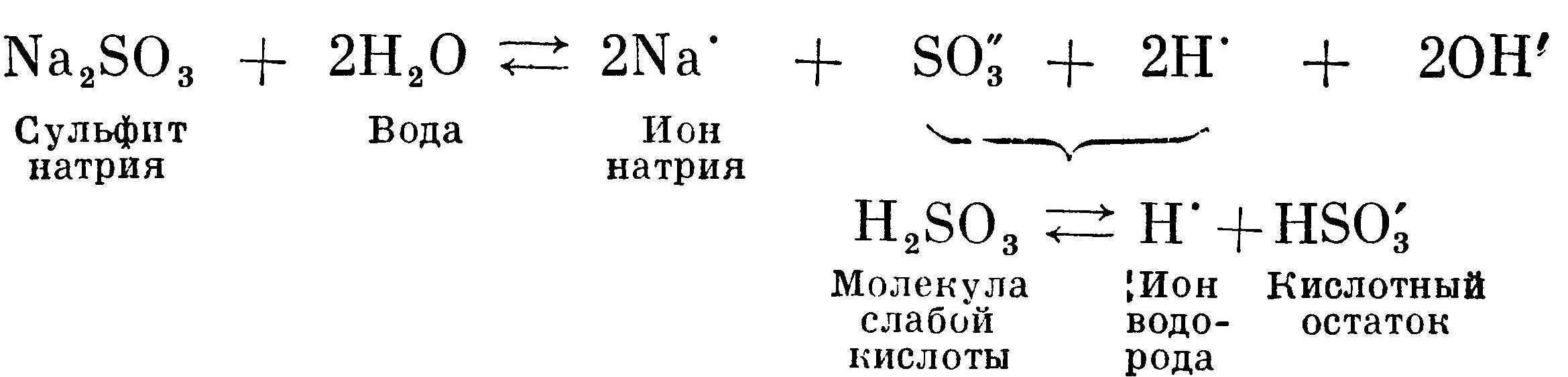 Гидролиз соли слабого основания и сильной кислоты идет по пути образования малодиссоциированных молекул слабого основания. На примере гидролиза сульфата алюминия можно показать, почему алюмокалиевые квасцы дают кислую реакцию:
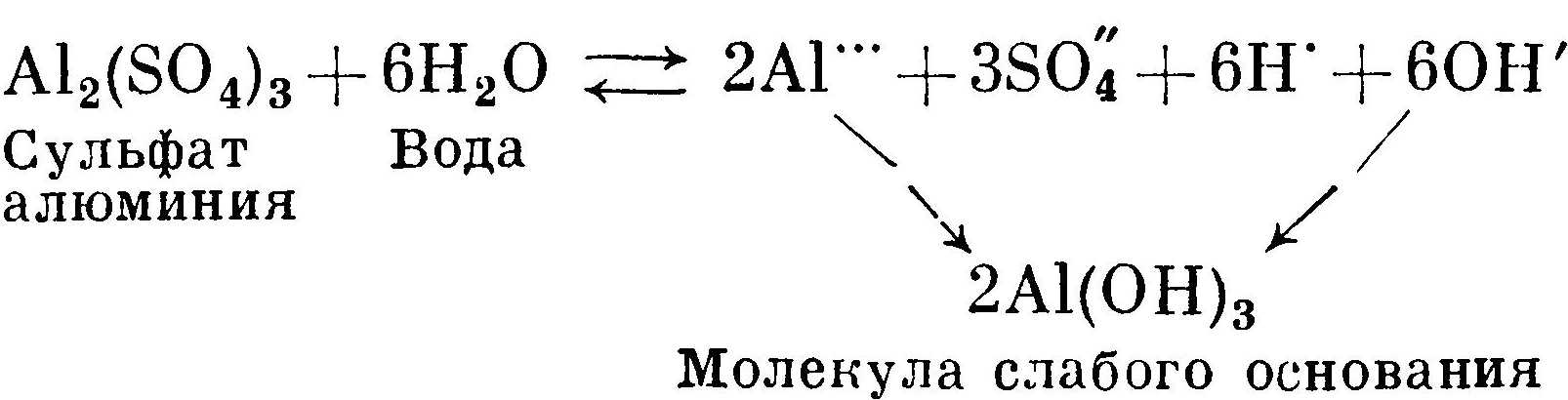 Гидрат окиси алюминия является слабым основанием, ион алюминия связывает гидроксильные ионы ОН'. В растворе остается избыточная концентрация хорошо диссоциированных ионов Н' и SO4. С повышением температуры скорости всех реакций возрастают. Соответственно увеличивается диссоциация. Гидрат окиси алюминия плохо растворим. Избыточная концентрация его будет выпадать в осадок. Поэтому рекомендуют растворять квасцы в холодной воде только из соображения ослабления гидролиза. Соли сильных кислот и сильных оснований гидролизу не подвергаются. Диссоциированные ионы не нарушают равновесия концентрации ионов водорода и гидроксила. Следовательно, реакция раствора нейтральна.
 Читайте также: Читайте также:
|
 Опрашиваем фотографов Опрашиваем фотографов
 Популярные материалы Популярные материалы
|
|
|
123567 г. Москва. ул. Печорская д. 654, т/ф. +7 (495) 235654 Химия для фотографа. Copyright © 2009. All rights reserved. |

