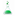 Химия для фотографа Химия для фотографа
|
Профессиональному фотографу » Химия для фотографа » Краткие сведения по химии » Обращение с химикатами и растворамиОбращение с химикатами и растворамиМногие химикаты чувствительны к свету, кислороду, углекислому газу и к воде. Поэтому хранить химикаты лучше всего в герметически закрытых сосудах из коричневого стекла, в сухом и прохладном помещении. Сосуды можно закрывать резиновыми, корковыми или полиэтиленовыми пробками, а также притертыми стеклянными пробками, кроме особо оговоренных случаев. Завинчивающиеся пластмассовые пробки должны иметь прокладки для герметизации.
Сосуды с широким горлом предназначены для твердых химикатов; сосуды с узким горлом — для жидкостей и растворов. Бутылки с растворами лучше всего закрывать резиновыми пробками или колпачками. Если бутыль заполнена жидкостью, то вставленная пробка выталкивается сжатым воздухом. Для предотвращения выталкивания пробки ее привязывают крепкой бечевкой, как это показано на рис. 3.  Рис. 3. Пример крепления пробки бечевкой для предупреждения выталкивания ее сжатым воздухом Сосуды с кислотами целесообразно ставить на подставки из фарфора, чтобы стекающие капли не повредили поверхности стола или полки.
Каждый сосуд обязательно должен иметь этикетку с названием химиката или раствора. Этикетку лучше всего приклеивать гидрофобным клеем, а надписи делать несмываемыми чернилами. Хорошо подходит паста шариковых ручек. Если этикетку покрыть цапоновым лаком, она не будет бояться растворов. С течением времени в фотолаборатории накапливаются различные химикаты. Они не должны стоять как попало.. Их следует располагать в строгом порядке, группируя по целевому назначению. Ядовитые химикаты надо держать закрытыми, отдельно от других, чтобы к ним не прикасались посторонние. Чтобы избежать несчастных случаев, не следует хранить растворы в посуде из-под пищевых продуктов, в частности, в пивных и винных бутылках. Внешний вид такой бутылки может ввести в заблуждение неосведомленного человека. В фотографической практике используют некоторые химикаты, которые изменяются в процессе хранения. Например, кристаллические вещества, как правило, выветриваются, т. е. теряют кристаллизационную воду. Содержание основного продукта в навеске вещества становится меньше. Карбонат натрия кристаллический десятиводный Na2CO3-10H2O содержит 63% кристаллизационной воды. При хранении в открытом сосуде в сухом помещении он превращается в моногидрат Na2CO3-H2O, белый порошок. Моногидрат карбоната натрия содержит 14,5% воды. Правда, до такого обеднения кристаллизационной водой дело доходит редко, но тем не менее потеря воды при неправильном хранении имеет место. Сульфит натрия кристаллический Na2SO3-7H2O при хранении в открытом сосуде не только теряет кристаллизационную воду, но и окисляется кислородом воздуха до сульфата натрия Na2SO4. Карбонат калия, или поташ, К2СO3, наоборот, так сильно поглощает влагу из воздуха, что растекается и полностью растворяется в поглощенной воде, и тогда уже правильная дозировка невозможна. Едкие щелочи NaOH и КОН впитывают углекислый газ и воду из воздуха. Поэтому сосуды, в которых они хранятся, должны быть закрыты пробками и залиты парафином. Стеклянные притертые пробки лучше не применять, так как они «пригорают» и их тяжело открывать. Для закрывания бутылок с растворами едких щелочей лучше всего применять резиновые пробки. Раствор железосинеродистого калия (красной кровяной соли) K3Fe(CN)6 под действием света разлагается с образованием железистосинеродистого калия (желтой кровяной соли), берлинской лазури и синильной кислоты. Яд! Поэтому раствор железосинеродистого калия надо хранить только в посуде из коричневого стекла. Безводные соли сульфита натрия и соды более стойкие. Их удобнее и взвешивать, так как они имеют порошкообразную форму. Растворение этих солей сопровождается небольшим выделением тепла, которое улучшает процесс. Температура раствора не должна превышать 45°С, так как слишком высокая температура ускоряет окисление веществ, что может привести к разложению некоторых из них. Для растворения небольших количеств солей применяют стеклянные конические колбы, фарфоровые кружки. Годится также эмалированная посуда, если только эмаль не повреждена. Совершенно непригодна алюминиевая посуда. Конические колбы удобны тем, что даже при значительном наклоне раствор через край не переливается. По мере увеличения раствора в колбе площадь соприкосновения с воздухом уменьшается, что также благоприятно с точки зрения сохранности раствора. Перемешивать растворы надо стеклянной палочкой с оплавленным концом в виде капли. Такая палочка удобна также при размельчении комочков солей, которые всегда образуются на дне сосудов при растворении. Стеклянная палочка может выполнять роль направляющего элемента при сливании растворов (особенно кислот и едких щелочей) из полных сосудов. Раствор потечет по палочке, а не по наружной стенке сосуда (рис. 4). Стеклянную палочку держат левой рукой, прижимают ее к верхнему краю сосуда и медленно наклоняют его. Стекающий по палочке раствор не будет разбрызгиваться и наружные стенки сосуда останутся чистыми. Эта мера предосторожности распространяется также на кружки и мензурки с носиком для слива. 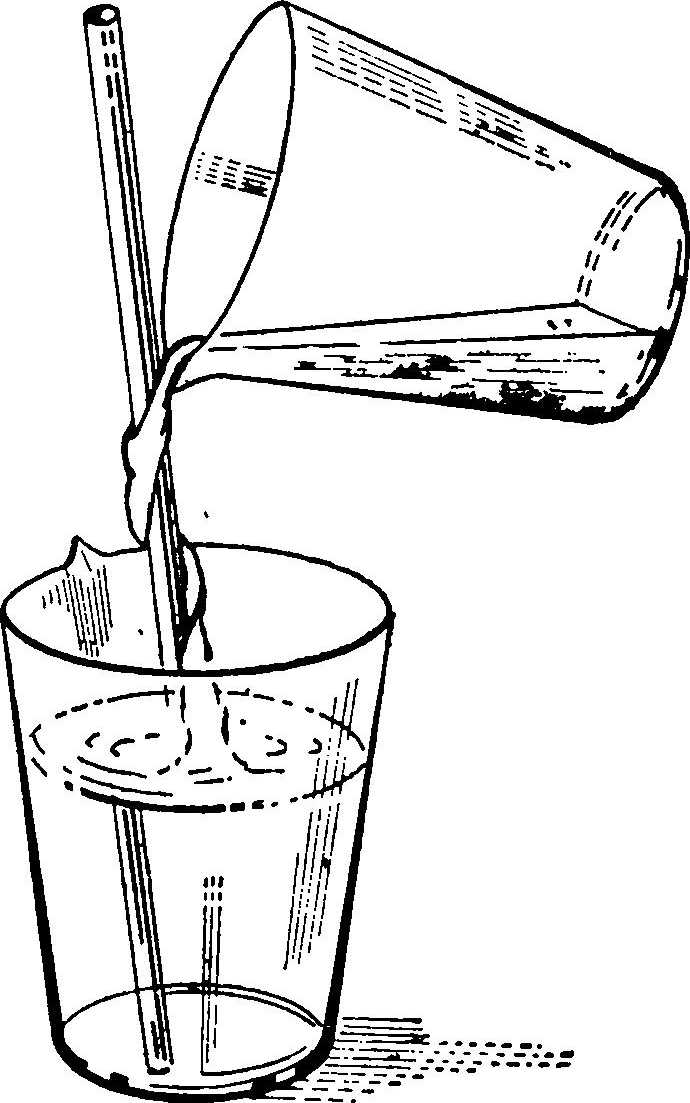 Рис. 4. Переливание раствора с помощью палочки
 Читайте также: Читайте также:
|
 Опрашиваем фотографов Опрашиваем фотографов
 Популярные материалы Популярные материалы
|
Загрузка. Пожалуйста, подождите...

