 Химия для фотографа Химия для фотографа
|
Профессиональному фотографу » Химия для фотографа » Краткие сведения по химии » Приготовление и фильтрация растворовПриготовление и фильтрация растворовВ фотографической практике используется много растворов. Поэтому для избежания путаницы следует приготовлять каждый раствор отдельно.
Сначала надо выписать на листок рецепт и проверить, не пропущена ли какая-либо его составная часть. При необходимости следует произвести пересчет на соответствующий объем раствора. Сделать навески химикатов, делая пометки в рецепте. Например, требуется составить 1200 мл проявителя следующего состава: Сульфит натрия безводный ......50 г ........60 г Амидол..................................5 г.......... 6 г Бромистый калий.....................2 г.........2,4 г Вода...................................до 1 .....до 1,2 л Во втором столбце указаны пересчитанные навески химикатов для требуемого объема проявителя. Эти количества и выписывают на отдельный листок, по которому делают навески и проверяют составные части рецепта.
Навески проявителя определяют составлением пропорции и решением ее относительно неизвестного. Например: 2 г бромистого калия в 1000 мл раствора, X г бромистого калия в 1200 мл раствора X = 2*1200/1000 = 2,4 г бромистого калия. Аналогичным образом определяют навески всех составных частей раствора для объема 1200 мл (1,2 л).
В большинстве случаев очередность растворения химикатов указана в рецепте. Нельзя присыпать последующий химикат, не дождавшись растворения предыдущего. Всегда благополучно и быстро составляются проявители из веществ, предварительно растворенных отдельно. В этом случае приготовление рабочего состава сводится только лишь к сливанию отдельных растворов и доведению общего объема добавлением необходимого количества воды. Приготовляя проявители, надо соблюдать некоторые правила. Сначала растворяют несколько граммов сульфита натрия из расчета на 1 л воды это делается для того, чтобы сульфит натрия первым принял на себя кислород, имеющийся в воде, и тем самым предупредил бы окисление проявляющих веществ. После этого растворяют метол, а затем весь сульфит натрия. Если сделать наоборот, то метол выпадет в осадок в виде крупных хлопьев. В этом случае образовавшийся осадок может быть растворен только нагреванием всего проявителя. Затем растворяют щелочь, а потом бромистый калий, так как он стоит в рецепте последним. Гидрохинон и глицин растворяют всегда после сульфита натрия. Фенидон лучше всего растворять отдельно в растворе сульфита при температуре 60—70°С. Раствор приобретает розоватый оттенок — цвет окисленной формы фенидона. Добавление гидрохинона восстанавливает окисленную форму фенидона, и проявитель опять становится бесцветным. Хорошо растворяется фенидон в щелочном растворе с сульфитом натрия и гидрохиноном. Крупинки фенидона можно растирать стеклянной палочкой. Полностью растворенный фенидон приливают к остальному раствору. Большие куски химикатов размельчают в фарфоровой ступке. Чтобы частички вещества не рассеивались вокруг, на пестик сверху накалывают лист бумаги. Если нет возможности размельчить большие куски кристаллического вещества, то при заполнении ими стеклянного сосуда следует обратить внимание на то, чтобы они не падали на дно, так как ими может быть разбит сосуд. В этом случае лучше использовать фарфоровый сосуд. При растворении обезвоженных солей (таких, как безводный сульфит натрия, сода кальцинированная) надо следить за тем, чтобы их высыпали в воду постепенно, помешивая. Если же вливать воду в соль, то образуется солевая корка, которая затрудняет дальнейшее растворение вещества. С едкими щелочами следует обращаться очень осторожно. Особенно надо беречь глаза, так как при размельчении кусков едких щелочей мелкие частички могут попасть в глаз и повредить его. Поэтому необходимо пользоваться защитными очками и иметь наготове 2%-ный раствор борной кислоты для промывания глаз или кожи при попадании на них частиц едкой щелочи. Чтобы сократить операции по взвешиванию едких щелочей, необходимый объем раствора определяют по навеске едкой щелочи, а не подгоняют вес под объем раствора. Например, по рецепту требуется 10 г NaOH для приготовления 1 л раствора проявителя. Взятый из банки кусок едкой щелочи имеет вес 12,5 г. По весу куска едкой щелочи определяют объем раствора составлением пропорции и решением ее относительно неизвестного: 10 г NaOH в 1000 мл раствора 12,5 г NaOH в X мл раствора Х =12,5*1000/10=1250 мл раствора. Аналогичным образом определяют навески других составных частей проявителя для объема 1250 мл. Например: 6 г гидрохинона в 1000 мл раствора X г гидрохинона в 1250 мл раствора X =6*1250/1000=7,5 г гидрохинона. Очень удобны для взвешивания едкие щелочи гранулированной формы. Процесс взвешивания едких щелочей надо производить быстро, так как они активно поглощают из воздуха влагу и углекислоту. Растворение едких щелочей сопровождается выделением большого количества тепла. Поэтому надо брать только холодную воду и следить за тем, чтобы при помешивании раствор не разбрызгивался. Раствор едкой щелочи приливают к составляемому проявителю постепенно, при помешивании. Бура, наоборот, требует теплой или горячей воды, так как она плохо растворяется. После охлаждения раствор буры приливают в общий раствор. Раствор сульфата натрия Na2SO4 добавляют к проявителю небольшими порциями. Брать химикаты из банки следует только чистой фарфоровой ложкой или совком из пластмассы. Для каждого химиката должен быть свой совок. Совершенно недопустимо брать химикаты голыми руками, а также высыпать обратно в банку химикат, побывавший на чашке весов. При соблюдении этого правила чистота продукта всегда будет сохранена. Очень легко оперировать концентрированными растворами с известным содержанием вещества при составлении фотографических растворов. Мы будем пользоваться весо-объемной концентрацией вещества в процентах, т. е. числом граммов растворенного сухого вещества на 100 мл раствора. Таким образом, число граммов безводного вещества, растворенного в условном объеме 100 мл, составляет соответствующий процент. Например, в 100 мл раствора содержится 40 г КВr; значит, мы имеем 40%-ный раствор КВr. Все рецепты, как правило, составлены на 1 л готового к употреблению раствора. Поэтому после приготовления раствора объем его доводят добавлением воды до 1 л, а не растворяют все химикаты в 1 л воды. Составлять разбавленные растворы с концентрацией 1% и 0,1% вещества лучше всего следующим образом. Взвесить 10 г вещества и приготовить 1 л раствора — это будет 1%-ный раствор. Для приготовления 0,1%-ного раствора надо взять 100 мл 1%-ного раствора и разбавлением водой довести объем до 1 л. Поскольку разбавляемые растворы рассчитываются на длительное хранение, их лучше всего приготовлять на дистиллированной воде. Рассмотрим два примера практических расчетов. Пример 1. В отбеливающий раствор требуется ввести 35 г КВr. Мы располагаем 40%-ным раствором КВr. Составляем пропорцию и решаем ее относительно неизвестного: 40 г КВr в 100 мл раствора 35 г КВr в X мл раствора X =35*100/40=87,5 мл 40%-кого раствора КВr. Пример 2. По рецепту требуется 6 мл 0,1%-ного раствора KJ. Чему равен вес сухого KJ? Составляем пропорцию и решаем ее относительно неизвестного: 0,1 г К J в 100 мл раствора (0,1%-ный раствор) X г К J в 6 мл раствора X =0.1*6/100= 0,006 г KJ. По тем или иным причинам часто бывает нужно разбавлять фотографические растворы водой. Например, требуется разбавить концентрированный раствор в отношении 1 : 2. В этом случае к 1 объемной части концентрированного раствора надо добавить 2 объемные части воды. Иногда встречается другое обозначение разбавления: 1+2, т. е. к 1 части проявителя надо добавить 2 части воды. В дальнейшем мы будем пользоваться только такой формой обозначения разбавления растворов. Если в рекомендации к раствору указано, что раствор перед употреблением нужно разбавить вдвое или втрое, это значит, что взятый для работы объем концентрированного раствора надо удвоить или утроить добавлением соответствующего объема воды, т. е., например, вместо 100 мл должно стать соответственно 200 или 300 мл разбавленного раствора. Перед взвешиванием химикатов следует обязательно проверить равновесие весов с листками на чашках. После этого на правую чашку кладут требуемый разновес (гирьки), а на левую — взвешиваемый химикат. На углу листочка с химикатом целесообразно написать название химиката и величину навески. Отмеривание необходимых объемов растворов делается при помощи мензурки или измерительного цилиндра. Емкость их определяется условиями надобности. Мензурки (мерные стаканы) служат для приблизительного отмеривания жидкости, а измерительные цилиндры — для более точных замеров растворов. Отсчет отмериваемого объема жидкости ведется по нижней части мениска (рис. 5).  Рис 5. Отсчет отмериваемого объема жидкости
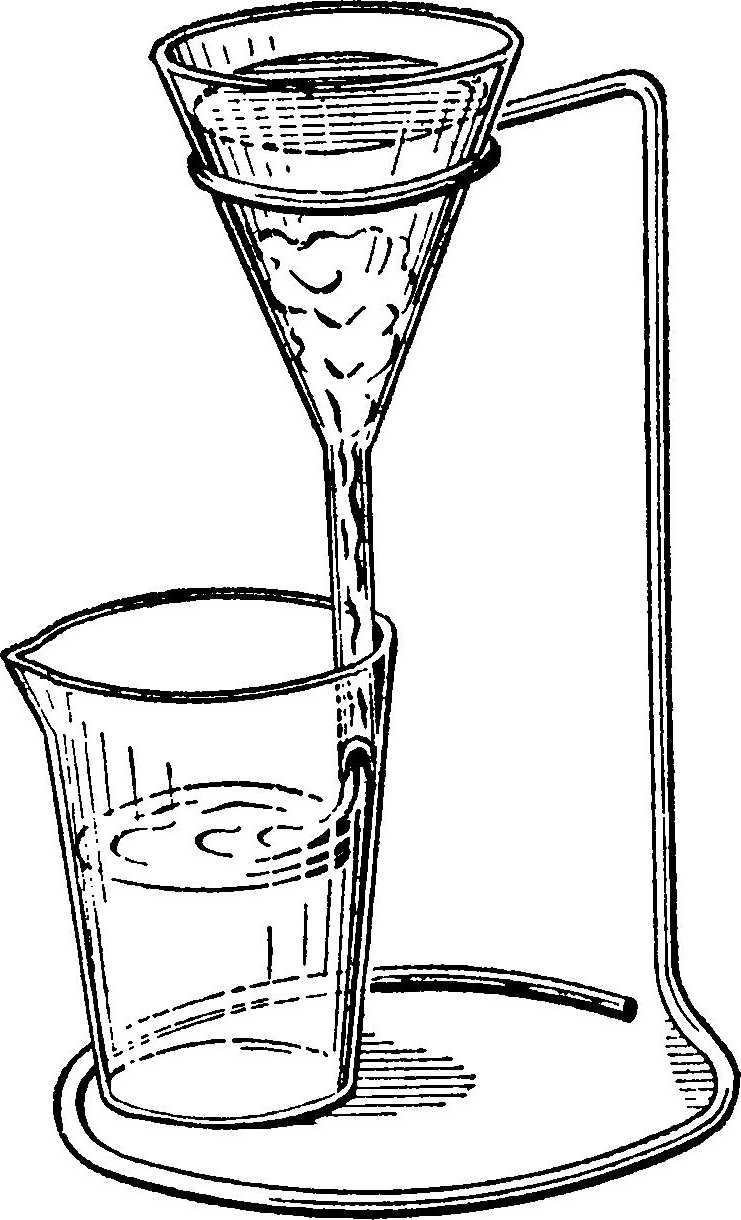 Рис. 6. Приспособление для фильтрации раствора
При взвешивании химикатов совершенно необязательно стремиться к скрупулезной точности. Точность необходимо соблюдать при взвешивании таких химикатов, которые предопределяют направление и скорость химической реакции. Например, изменение концентрации йодистого калия на 0,003 г в первом черно-белом проявителе для цветной обращаемой фотопленки сказывается на изменении цвета. Изменение концентрации про-тивовуалирующих веществ отражается на скорости проявления и светочувствительности фотоматериала. Изменение концентрации роданидов в проявителях для обращаемых фотоматериалов сказывается на чистоте светов, максимальной плотности и светочувствительности. Соблюдение точности при взвешивании химикатов требуется для выполнения условия воспроизводимости результатов обработки при проявлении обращаемых и негативных фотоматериалов, и особенно цветных. В общем виде можно лишь указать, что точное взвешивание необходимо для химикатов, которые входят в раствор в малых концентрациях. Довольно широкие допуски на точность взвешивания химикатов возможны при приготовлении растворов, применяемых в процессах, контролируемых визуально, например черно-белых проявителей для фотобумаг, отбеливающих и фиксирующих растворов. Для приготовления таких растворов в домашней практике вполне достаточно пользоваться мерками вместо взвешивания на весах. Однажды сделав навески химикатов и измерив их объем подходящей меркой, можно значительно упростить процесс приготовления раствора в дальнейшем. Обилие очень похожих друг на друга рецептов говорит о том, что все они работоспособны. Зная роль составных элементов рецепта, можно сразу определить свойства раствора в целом. После отстаивания растворов, приготовленных на жесткой воде, образуется осадок известкового происхождения. В осадок выпадают также другие нерастворимые вещества, образующиеся в процессе использования растворов,— так называемый шлам, буро-серый осадок. Общее количество шлама в цветном проявителе больше, чем в черно-белом. Чем выше чистота обрабатывающих растворов, тем выше чистота эмульсионного слоя, а это особенно важно для малоформатных фотоматериалов. Очень чувствительны к грязным растворам эмульсии цветных обращаемых фотопленок. Микроскопические кусочки ржавчины, имеющиеся в водопроводной воде, врезаются в слой и портят его. Фильтрация растворов так же необходима, как и чистая вода для промывки фотопленок. При фильтрации воронку надо устанавливать в кольцо, а не в горлышко бутылки или колбы. Стекающий отфильтрованный раствор следует направить на стенки сосуда, чтобы он не капал отдельными каплями (рис. 6).
 Читайте также: Читайте также:
|
 Опрашиваем фотографов Опрашиваем фотографов
 Популярные материалы Популярные материалы
|
Загрузка. Пожалуйста, подождите...

