Гидролиз карбоната натрия и Сульфит натрия
Гидролиз карбоната натрия Na2CO3.
Соль получена в результате реакции взаимодействия между сильным основанием NaOH и слабой кислотой Н2СO3. Сама по себе соль
нейтральна, так как она не содержит ни одного атома водорода или гидроксила. В растворе соль диссоциирует на ионы Na' и С03. Вода также диссоциирована на ионы Н' и ОН', но число их одинаково и реакция нейтральная:
нейтральна, так как она не содержит ни одного атома водорода или гидроксила. В растворе соль диссоциирует на ионы Na' и С03. Вода также диссоциирована на ионы Н' и ОН', но число их одинаково и реакция нейтральная:
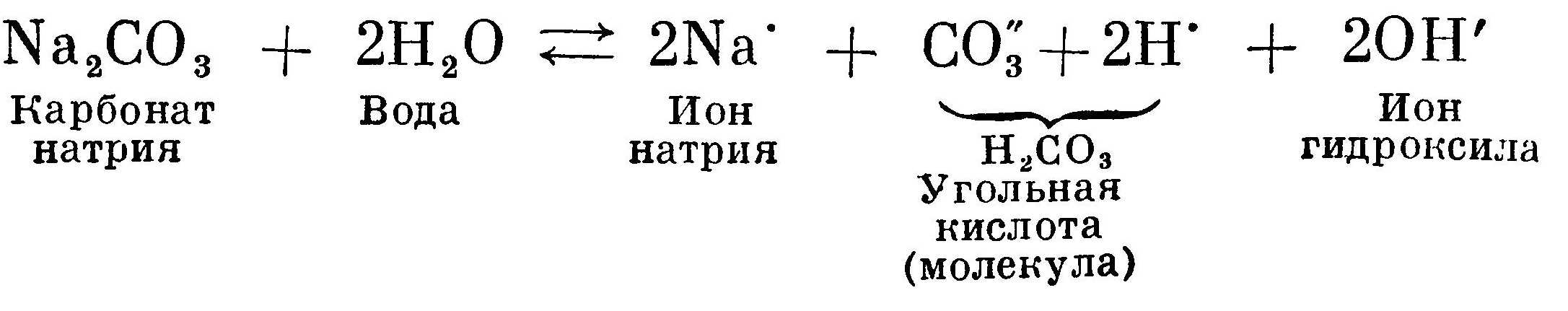
В растворе образуются почти недиссоциированные молекулы угольной кислоты. Тем самым концентрация ионов водорода уменьшается, а концентрация ионов ОН' увеличивается. Реакция становится щелочной за счет избытка ионов гидроксила ОН'. Процесс продолжается до равновесного состояния.
Сульфит натрия Na2SO3 также получен из сильного основания NaOH и слабой кислоты H2SO3. Сернистая кислота H2SO3 сильнее угольной кислоты H2CO3, потому что сильнее диссоциирует. Соответственно она связывает меньшее число ионов водорода, чем угольная кислота. Концентрация ионов водорода в растворе больше, чем в примере с карбонатом натрия. Поэтому раствор сульфита натрия носит менее щелочной характер, чем раствор с карбонатом натрия:
Сульфит натрия Na2SO3 также получен из сильного основания NaOH и слабой кислоты H2SO3. Сернистая кислота H2SO3 сильнее угольной кислоты H2CO3, потому что сильнее диссоциирует. Соответственно она связывает меньшее число ионов водорода, чем угольная кислота. Концентрация ионов водорода в растворе больше, чем в примере с карбонатом натрия. Поэтому раствор сульфита натрия носит менее щелочной характер, чем раствор с карбонатом натрия:
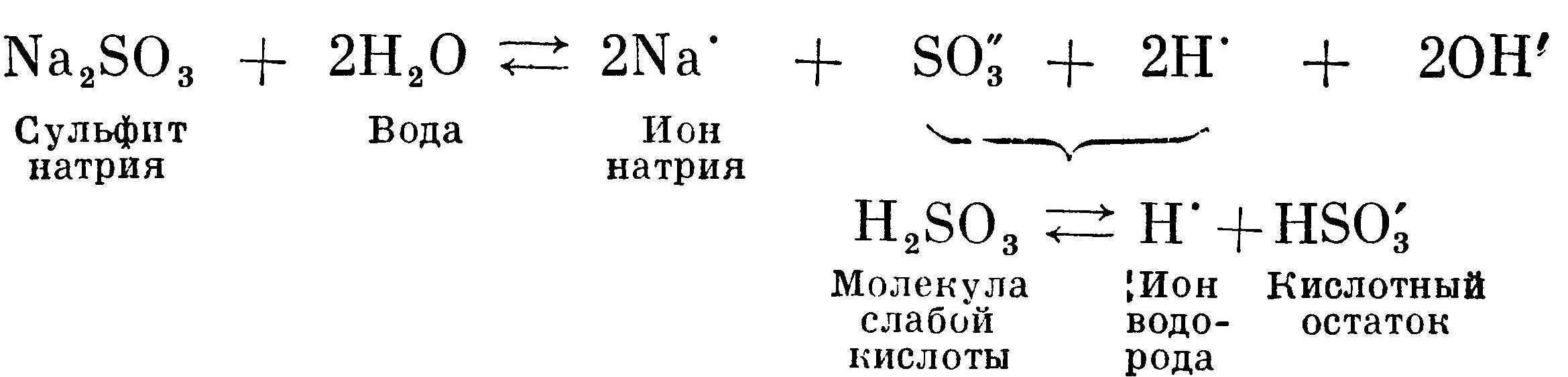
Гидролиз соли слабого основания и сильной кислоты идет по пути образования малодиссоциированных молекул слабого основания. На примере гидролиза сульфата алюминия можно показать, почему алюмокалиевые квасцы дают кислую реакцию:
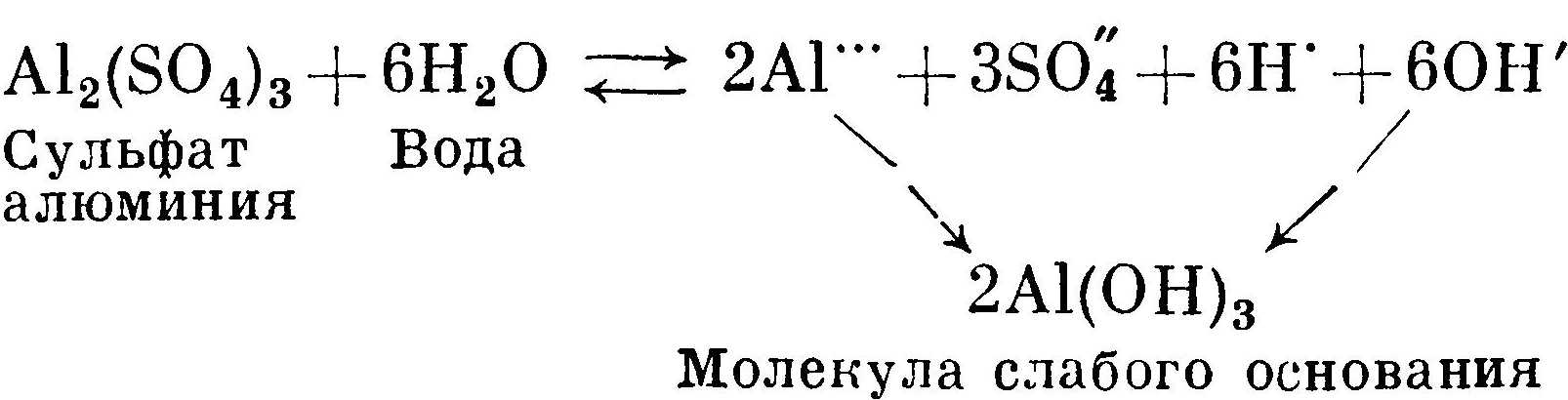
Гидрат окиси алюминия является слабым основанием, ион алюминия связывает гидроксильные ионы ОН'. В растворе остается избыточная концентрация хорошо диссоциированных ионов Н' и SO4.
С повышением температуры скорости всех реакций возрастают. Соответственно увеличивается диссоциация. Гидрат окиси алюминия плохо растворим. Избыточная концентрация его будет выпадать в осадок. Поэтому рекомендуют растворять квасцы в холодной воде только из соображения ослабления гидролиза.
Соли сильных кислот и сильных оснований гидролизу не подвергаются. Диссоциированные ионы не нарушают равновесия концентрации ионов водорода и гидроксила. Следовательно, реакция раствора нейтральна.
С повышением температуры скорости всех реакций возрастают. Соответственно увеличивается диссоциация. Гидрат окиси алюминия плохо растворим. Избыточная концентрация его будет выпадать в осадок. Поэтому рекомендуют растворять квасцы в холодной воде только из соображения ослабления гидролиза.
Соли сильных кислот и сильных оснований гидролизу не подвергаются. Диссоциированные ионы не нарушают равновесия концентрации ионов водорода и гидроксила. Следовательно, реакция раствора нейтральна.