 Химия для фотографа Химия для фотографа
|
Профессиональному фотографу » Химия для фотографа » Краткие сведения по химии » Кислоты, основания, соли и гидролиз солейКислоты, основания, соли и гидролиз солейКислотами называют соединения, которые в водных растворах дают в качестве катиона только положительно заряженный ион водорода. Кислотным остатком является анион — отрицательно заряженный ион. Кислотный остаток — соединение неметаллическое, в большинстве случаев в его состав входит кислород. Исключение составляют кислотные остатки галогенидных кислот (HCl, НВr и т. д.) и синильной кислоты HCN.
Чем больше концентрация водородных ионов в растворе, тем сильнее кислота. Сильные кислоты в водных растворах диссоциируют практически полностью. Водные растворы слабых кислот, кроме того, имеют частично диссоциированные молекулы и совершенно недиссоцииро-ванные молекулы. Например, раствор борной кислоты Н3ВO3 содержит катионы водорода Н , кислотные остатки ВO'''3, НВO''3, Н2ВO'3 и недиссоциированные молекулы Н3В03. Причем полностью диссоциированных молекул очень мало. Следовательно, в растворе борной кислоты мала концентрация водородных ионов. Чем больше концентрация водородных ионов в растворе, тем сильнее кислота и соответственно меньше величина рН раствора. К сильным кислотам относятся соляная НСl, азотная HNO3, серная H2SO4; к слабым кислотам — сернистая H2SO3, угольная Н2СO3, ортофосфорная Н3РO4, борная Н3ВO3, а также большинство органических кислот. Основаниями называют соединения, которые в водных растворах в качестве аниона дают только гидрок-сильную группу ОН' (отрицательно заряженную частицу). Мыльный на ощупь раствор указывает на присутствие гидроксила ОН'. Чем больше концентрация гидроксильных групп ОН' в растворе, тем сильнее основание и соответственно больше величина рН раствора. Основания бывают сильные и слабые. Сильные основания образованы щелочными металлами Na и К. Основания называют гидроксидами, гидроокисями или гидратами окиси с прибавлением названия соответствующего металла. Например, NaOH — гидроксид натрия, гидроокись натрия, гидрат окиси натрия. Сильные основания называют также едкими щелочами, поскольку они образованы щелочными металлами. Нейтрализация — реакция между кислотой и основанием, в результате которой получаются соль и вода. В качестве примера можно привести реакцию между соляной кислотой и гидроокисью натрия: 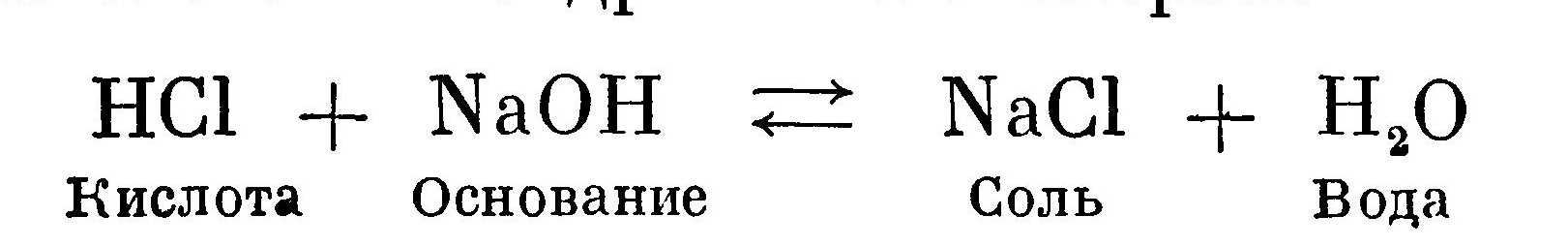 Соль, образованная сильной кислотой и сильным основанием, при растворении дает нейтральную реакцию. Если соль получена в результате реакции между сильной кислотой и слабым основанием, то такая соль в растворе дает кислую реакцию, например сульфат магния MgS04, и наоборот, щелочную реакцию дают соли, полученные в результате реакции между слабой кислотой и сильным основанием, например сульфит натрия Na2SO3 или карбонат натрия (сода) Na2CO3. Кислая или щелочная реакция получается в результате гидролиза соответствующих солеи, так как участником реакции становится вода. Объясняется это тем, что при растворении соли в воде процесс не заканчивается диссоциацией на составляющие соль ионы. В диссоциации начинает принимать активное участие вода, которая также диссоциирована. Активное взаимодействие между ионами соли и воды, в результате которого меняется кислотность раствора, называется гидролизом. Слабые кислоты и основания диссоциируют частично. В их растворах всегда имеются недиссоциированные молекулы. При растворении солей, образованных в результате реакции разноактивных кислот и основании, диссоциированные ионы слабых кислот или слабых оснований начинают вступать в реакцию взаимодействия с соответствующими ионами воды, в результате чего одна часть ионов воды (Н' или ОН') связывается, а другая остается в избытке. Избыточная часть ионов Н' или ОН' и определяет в конечном счете характер реакции.
 Читайте также: Читайте также:
|
 Опрашиваем фотографов Опрашиваем фотографов
 Популярные материалы Популярные материалы
|
Загрузка. Пожалуйста, подождите...

