Вода, ее свойства и растворы
Свойства воды зависят от ее происхождения. Для приготовления фотографических растворов годится питьевая вода, т. е. прозрачная, бесцветная, без привкуса и запаха. Но всеми перечисленными признаками обладает и жесткая вода. Общая жесткость воды обусловливается присутствием в ней солей кальция, магния, железа и др.
Кипячением воды устраняется временная жесткость, или карбонатная, так как при нагревании растворимые кислые углекислые соли кальция и магния превращаются в нерастворимые карбонатные соли, которые выпадают в осадок и образуют накипь на стенках сосудов. Этот процесс можно записать уравнением:
Кипячением воды устраняется временная жесткость, или карбонатная, так как при нагревании растворимые кислые углекислые соли кальция и магния превращаются в нерастворимые карбонатные соли, которые выпадают в осадок и образуют накипь на стенках сосудов. Этот процесс можно записать уравнением:
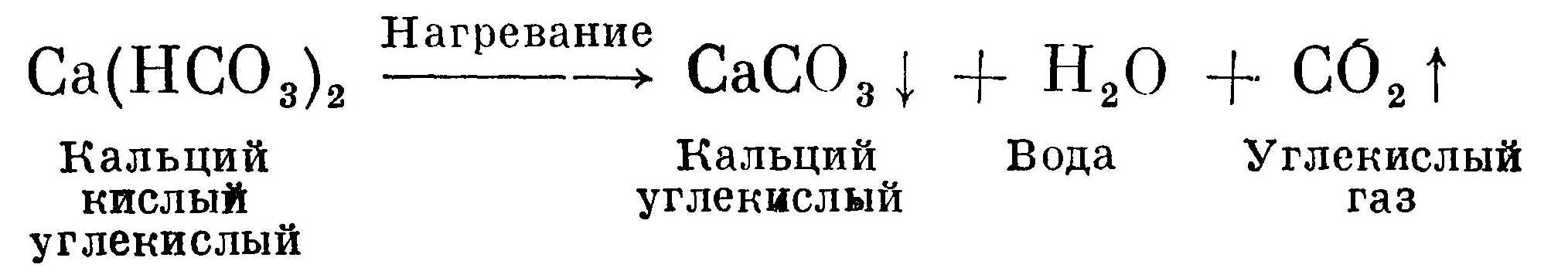
Стрелка вниз показывает, что соединение выпадает в осадок. Стрелка вверх обозначает, что соединение улетучивается, т. е. оно газообразно (в нашем примере углекислый газ).
Процесс выпадения в осадок при кипячении кислой углекислой соли магния идет по более сложной реакции:
Процесс выпадения в осадок при кипячении кислой углекислой соли магния идет по более сложной реакции:
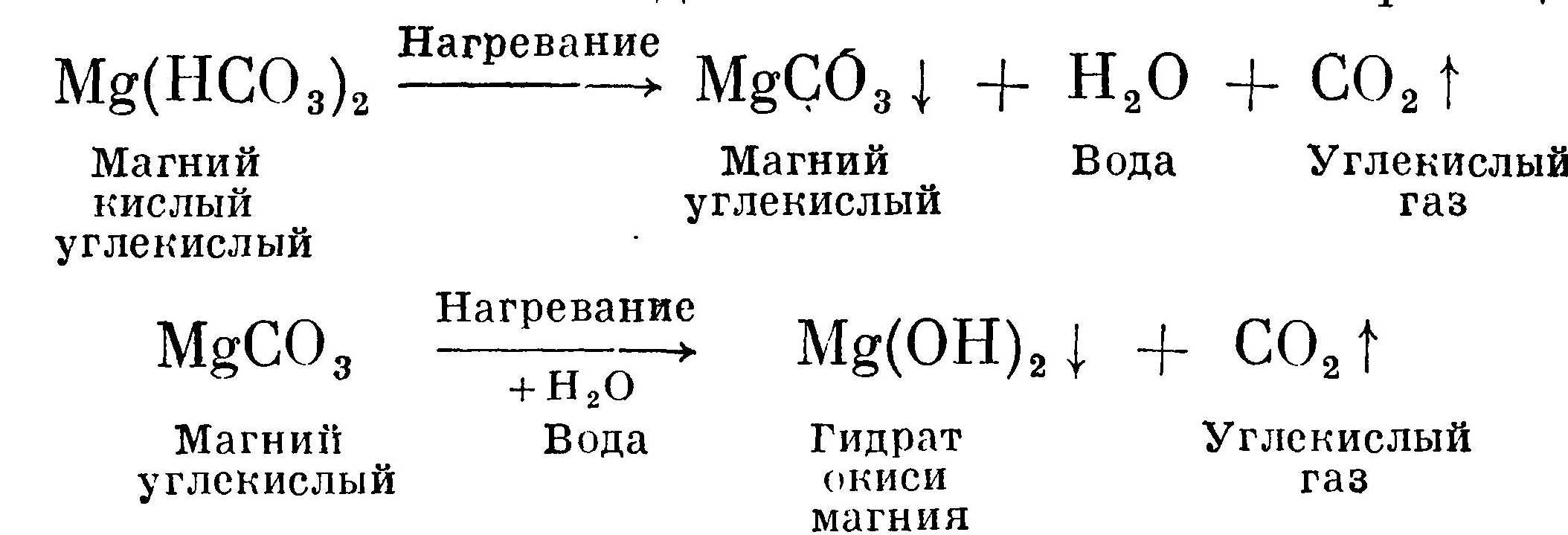
Превращение углекислого магния в гидрат окиси магния происходит потому, что последний менее растворим, чем первый.
В природе нет абсолютно нерастворимых веществ, а есть вещества хорошо растворимые и труднорастворимые. Так, например, с каждого квадратного сантиметра стеклянного сосуда каждый день растворяется до 0,2 мг веществ, из которых состоит стекло. В воде также растворяются составные части воздуха (кислород, азот, углекислый газ и др.). Наличие в воде тех или иных примесей определяет пригодность воды для фотографических растворов. Например, присутствие в воде следов меди особенно вредно для цветного проявителя, а растворенный кислород окисляет проявляющие вещества.
Самая чистая вода — это дистиллированная. Ее можно получить при помощи обычной перегонки. Лед, снятый с холодильника, можно использовать как дистиллированную воду. Дождевая вода или вода, полученная от растаявшего снега, тоже может заменить дистиллированную воду. Но в такой воде содержится большое количество пыли, так как каждая капля дождя образуется вокруг пылинки, являющейся центром конденсации. Поэтому дождевую воду следует отфильтровать или после осаждения пыли осторожно слить. Прежде всего это относится к дождевой воде индустриальных районов, где запыленность воздуха очень велика.
Водопроводная вода в большинстве случаев имеет стерилизующие добавки, например хлор, гипохлорид. Следы этих добавок вредны для фотоматериалов, и особенно для цветных. При нагревании воды они улетучиваются.
Вода рек и озер богата органическими веществами. В противоположность ей грунтовая вода (колодезная, артезианская) содержит мало органических веществ, но богата солями.
Морская вода содержит очень много растворимых солей.
Прозрачность и бесцветность воды не может являться критерием чистоты воды. Например, прозрачная колодезная вода содержит достаточно много минеральных веществ, в основном двууглекислых солей кальция, магния и др., которые, собственно, и определяют жесткость воды.
В России жесткость воды выражается в миллиграмм-эквивалентах на литр (мг-экв/л).
Мягкая вода характеризуется общей жесткостью до 3 мг-экв/л. Жесткая вода — от 6,5 до 11 мг-экв/л. Свыше 11 мг-экв/л вода очень жесткая. Хорошая питьевая вода характеризуется общей жесткостью до 7 мг*экв/л.
Жесткость воды непостоянна в течение года и даже бывает непостоянна в пределах одного большого города.
В табл. 4 даны сведения о величине общей жесткости воды природных источников на территории СССР.
В природе нет абсолютно нерастворимых веществ, а есть вещества хорошо растворимые и труднорастворимые. Так, например, с каждого квадратного сантиметра стеклянного сосуда каждый день растворяется до 0,2 мг веществ, из которых состоит стекло. В воде также растворяются составные части воздуха (кислород, азот, углекислый газ и др.). Наличие в воде тех или иных примесей определяет пригодность воды для фотографических растворов. Например, присутствие в воде следов меди особенно вредно для цветного проявителя, а растворенный кислород окисляет проявляющие вещества.
Самая чистая вода — это дистиллированная. Ее можно получить при помощи обычной перегонки. Лед, снятый с холодильника, можно использовать как дистиллированную воду. Дождевая вода или вода, полученная от растаявшего снега, тоже может заменить дистиллированную воду. Но в такой воде содержится большое количество пыли, так как каждая капля дождя образуется вокруг пылинки, являющейся центром конденсации. Поэтому дождевую воду следует отфильтровать или после осаждения пыли осторожно слить. Прежде всего это относится к дождевой воде индустриальных районов, где запыленность воздуха очень велика.
Водопроводная вода в большинстве случаев имеет стерилизующие добавки, например хлор, гипохлорид. Следы этих добавок вредны для фотоматериалов, и особенно для цветных. При нагревании воды они улетучиваются.
Вода рек и озер богата органическими веществами. В противоположность ей грунтовая вода (колодезная, артезианская) содержит мало органических веществ, но богата солями.
Морская вода содержит очень много растворимых солей.
Прозрачность и бесцветность воды не может являться критерием чистоты воды. Например, прозрачная колодезная вода содержит достаточно много минеральных веществ, в основном двууглекислых солей кальция, магния и др., которые, собственно, и определяют жесткость воды.
В России жесткость воды выражается в миллиграмм-эквивалентах на литр (мг-экв/л).
Мягкая вода характеризуется общей жесткостью до 3 мг-экв/л. Жесткая вода — от 6,5 до 11 мг-экв/л. Свыше 11 мг-экв/л вода очень жесткая. Хорошая питьевая вода характеризуется общей жесткостью до 7 мг*экв/л.
Жесткость воды непостоянна в течение года и даже бывает непостоянна в пределах одного большого города.
В табл. 4 даны сведения о величине общей жесткости воды природных источников на территории СССР.
Таблица 4
Жесткость воды природных источников
| Природный водоисточник (река, озеро) |
Общая жесткость,
мг • экв/л |
| Амур Байкал Балхаш Волга Днепр Кама Кура Москва Нева Обь Ока Урал |
1,5
1,1
11,4
6,5
4,2
2,4
5,4
4,5
0,8
3,2
5,4
8,2
|
Очистка воды может быть осуществлена несколькими способами.
Кипячение воды способствует устранению вредной временной жесткости, а также микроорганизмов. С повышением температуры в воде снижается содержание растворенных газов, в том числе кислорода и хлора. Поэтому необходимо кипятить воду перед составлением растворов.
Когда применяются большие количества воды, то сразу возникают чисто технические трудности по очистке. В этом случае можно сделать химическую очистку воды, не прибегая к кипячению, добавляя на каждые 100 л воды либо 25 г алюмокалиевых квасцов, либо 100 г тринатрийфосфата.
Оба вещества осаждают кальциевые соли и коагулируют слизистые примеси, присутствующие в воде. Через 12 ч отстоявшаяся вода становится чистой и прозрачной. Чистую воду сливают и используют для составления растворов. Так как фосфат кальция менее растворим, чем карбонат кальция, то реакция идет практически до конца с выпадением первого в осадок:

Фосфат кальция выпадает в осадок большими хлопьями, обволакивая при этом коллоидальную кремневую кислоту и силикат натрия, выводя их при этом также в осадок.
В настоящее время вместо удаления кальциевых солей широко применяют добавки специальных солей — водоумягчителей, которые связывают ионы кальция, магния и других двухвалентных металлов посредством образования растворимых комплексных соединений. К ним относятся полифосфаты и органические кислоты или их соли.
Наибольшее распространение получили гексаметафосфат натрия (NaPO3)6, пирофосфат натрия Na4P2O7-10H2O, тетрафосфат натрия Na6P4O12, этилендиаминтетрауксусная кислота и ее динатриевая соль.
Отличительная особенность смеси калгон — нейтральная реакция ее раствора.
Гексаметафосфат натрия имеет слабокислую реакцию. Гидролиз соли при нормальной температуре проходит очень медленно, особенно в нейтральных растворах.
Гексаметафосфат натрия связывает двухвалентные ионы металлов. Образующаяся комплексная соль растворима:
В настоящее время вместо удаления кальциевых солей широко применяют добавки специальных солей — водоумягчителей, которые связывают ионы кальция, магния и других двухвалентных металлов посредством образования растворимых комплексных соединений. К ним относятся полифосфаты и органические кислоты или их соли.
Наибольшее распространение получили гексаметафосфат натрия (NaPO3)6, пирофосфат натрия Na4P2O7-10H2O, тетрафосфат натрия Na6P4O12, этилендиаминтетрауксусная кислота и ее динатриевая соль.
Отличительная особенность смеси калгон — нейтральная реакция ее раствора.
Гексаметафосфат натрия имеет слабокислую реакцию. Гидролиз соли при нормальной температуре проходит очень медленно, особенно в нейтральных растворах.
Гексаметафосфат натрия связывает двухвалентные ионы металлов. Образующаяся комплексная соль растворима:
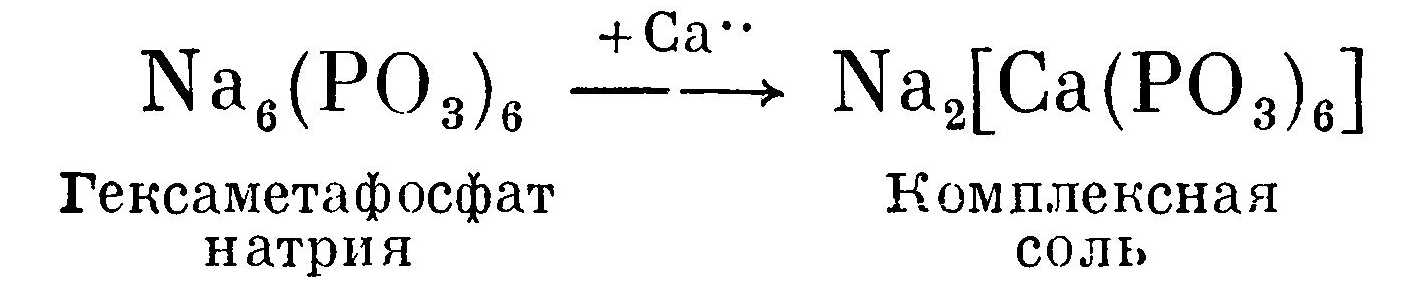
Для умягчения 1 л воды жесткостью 1 мг*экв/л добавляют 0,31 г гексаметафосфата натрия при пересчете на 100%-ное содержание. Но так как продукт обычно содержит около 75% основного вещества, то соответственно на каждый мг*экв/л жесткости надо добавлять 0,45 г гексаметафосфата натрия на 1 л воды.
В цветных проявляющих растворах применяют гексаметафосфат натрия или калгон, но не трилон-Б.
Этилендиаминтетрауксусная кислота и ее динатриевая соль (трилон-Б) также связывают двухвалентные ионы металлов. Водно-растворимые комплексы динатриевая соль образует в щелочной среде. В нейтральной среде она смягчающего действия не оказывает.
Одна молекула трилона-Б связывает в комплекс один ион кальция, магния или меди. Для умягчения 1 л воды жесткостью 1 мг-экв/л можно также добавлять 0,45 г динатриевой соли этилендиамннтетрауксусной кислоты.
В цветных проявляющих растворах применяют гексаметафосфат натрия или калгон, но не трилон-Б.
Этилендиаминтетрауксусная кислота и ее динатриевая соль (трилон-Б) также связывают двухвалентные ионы металлов. Водно-растворимые комплексы динатриевая соль образует в щелочной среде. В нейтральной среде она смягчающего действия не оказывает.
Одна молекула трилона-Б связывает в комплекс один ион кальция, магния или меди. Для умягчения 1 л воды жесткостью 1 мг-экв/л можно также добавлять 0,45 г динатриевой соли этилендиамннтетрауксусной кислоты.